 您的购物车当前为空
您的购物车当前为空

- 具有直观的搜索结果
- 更便捷高效地比较产品细节
- 快速、简洁的提交订单
- 成为我们TargetMol的一员,阅读和提交您的产品建议和意见
我们很想知道您的意见反馈,所以我们在每个页面上都梳理出一个反馈按钮。

近日,洛克菲勒大学(Rockefeller University)的 Matthew T. Tierney 博士团队在 Science 期刊上发表了一项研究,揭示了维生素 A 未知的功能。他们发现,维生素 A 的代谢产物 atRA 可视作一把“双刃剑”——低水平的 atRA 可刺激伤口修复,但会让毛发周期停止导致脱发,而高水平的 atRA 则无法有效协助干细胞进入伤口修复状态。
▲点击跳转原文
长头发还是长皮肤?
在正常情况下,成体干细胞受到微环境的严格调控,以确保自我更新和产生各种分化细胞类型。然而,一旦受伤,这种稳态往往会被打破,干细胞会从正常的约束中释放出来,并被重新定位到最需要修复的受伤区域。
毛囊干细胞(HFSCs)作为损伤修复的主要应答者,在损伤修复过程中会进入一个多步骤过程,首先涉及 HFSCs 进入“谱系可塑性”,然后是从 HFSCs 到表皮干细胞(EpSCs)的后续命运转变,最后是在组织区域之间重新平衡干细胞数量。
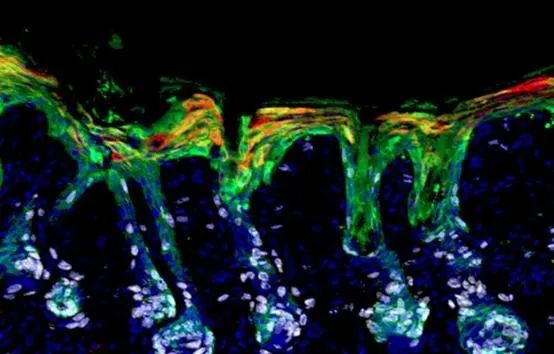
▲毛囊干细胞(绿色)迁移和扩增(白色),通过分化为表皮谱系(红色),帮助修复皮肤屏障

小贴士
谱系可塑性是指干细胞或祖细胞在特定条件下可以表达多个细胞谱系的特征或功能。这种状态使得干细胞能够跨越其正常的谱系限制,从分化为A类细胞转变为分化B类细胞(例如促进毛囊生长的毛囊干细胞HFSC在皮肤受伤后会转为修复伤口、再生表皮),以满足特定的生理或修复需求。
根据受伤的程度,不同比例的毛囊干细胞(HFSCs)和表皮干细胞(EpSCs)将迁出其微环境并进入谱系可塑性状态,以再生表皮。需要注意的是,一旦干细胞进入谱系可塑性,它们就无法有效地发挥任何作用,直到它们选择最终的转化方向。
新发现
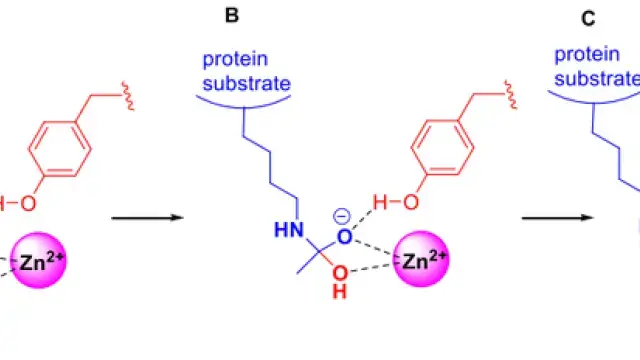
在这项研究中,研究者发现全反式维甲酸(atRA)对于干细胞最终分化方向的命运抉择至关重要。
通过检测 atRA 合成的速率限制酶 ALDH1 的表达模式和活性,以及对 HFSC 进行转导实验和小鼠模型研究,发现 atRA 通过调节染色质水平来调控 HFSC 的谱系可塑性,维持其干细胞特性。
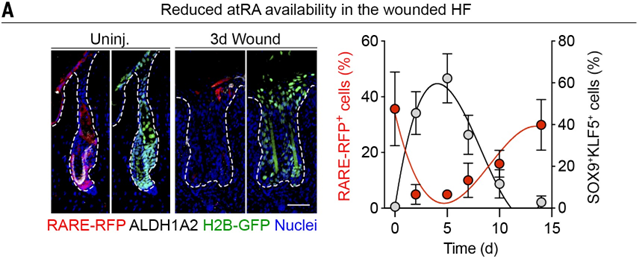
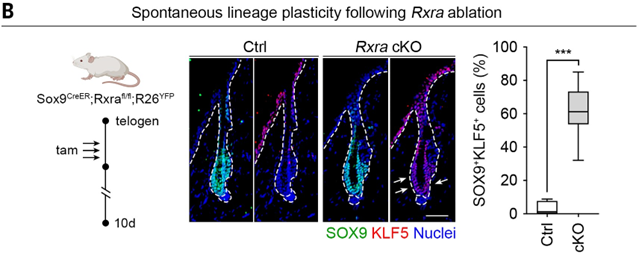
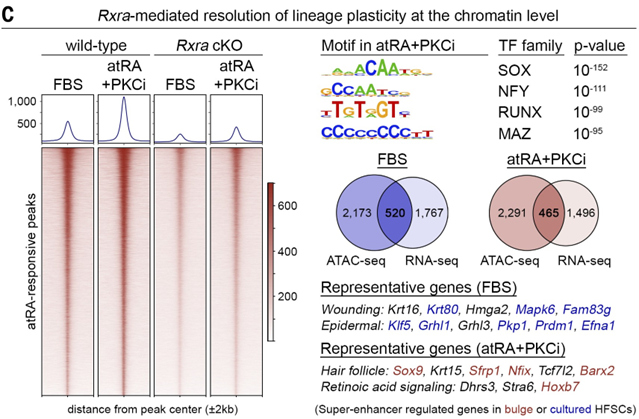
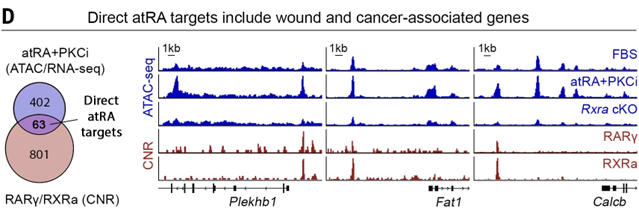
▲atRA调控谱系可塑性(上下滑动查看)
进一步的机制研究表明,atRA 通过调节维甲酸 X 受体 (RXR)-维甲酸受体 (RAR) 转录因子复合物,可以调节细胞的分化、增殖和谱系选择。例如,上调关键基因如 Sox9,从而促进 HFSC 分化,并同时下调 Klf5 抑制 EpSC 分化,影响毛囊干细胞在修复皮肤伤口和恢复毛发生长之间的平衡。但 atRA 要实现这一作用,还需要与 BMP、WNT 等信号因子协作。

▲atRA在伤口愈合过程中协调干细胞谱系可塑性
研究人员还在更具临床相关性的场景中对此进行了评估。
与先前的结果一致,当小鼠局部使用 atRA 时,可以减少 HFSCs 进入谱系可塑性状态,加速毛发从休止期进入生长期,促进毛发再生,且呈剂量依赖形式。
当将小鼠置于缺乏维生素 A 的饮食中时,会导致 HFSCs 进入持续的双谱系潜力状态,从而延迟毛发再生,这时谱系追踪的 HFSCs 更倾向于重新再生表皮。
小结
综上,该研究表明,维生素A,特别是全反式维甲酸(atRA),在解决成体干细胞,特别是毛囊干细胞(HFSCs)的谱系可塑性中发挥着关键作用。
atRA在皮肤再上皮化过程中作为谱系可塑性的强效上游调节因子,有助于在体外和体内恢复干细胞的生理特性。通过维持谱系特异性,atRA使干细胞能够在组织稳态和修复过程中平衡其对不同命运选择和谱系的贡献。atRA的可用性对于HFSCs在体外有效产生不同谱系,以及在体内再生毛发和修复受伤表皮至关重要,有望为将来治疗与毛发生长、皮肤修复等相关的疾病提供方向。

科研助力

TargetMol® 可为您提供 mirdametinib、SB-431542 、forskolin 、干细胞分化化合物库 等助力相关研究。如感兴趣或有疑问可私聊咨询噢~
参考资料:
Matthew T. Tierney et al. ,Vitamin A resolves lineage plasticity to orchestrate stem cell lineage choices.Science383,eadi7342(2024).DOI:10.1126/science.adi7342
其他文章

订阅TargetMol新闻
科学新闻、观点和分析的重要汇总,每个工作日都会发送到您的收件箱.

 嗨!有任何问题?点我咨询
嗨!有任何问题?点我咨询

版权所有©2015-2025 TargetMol Chemicals Inc.保留所有权利.
沪ICP备20019793号-4 | 沪公网安备 31010602006700号 | 沪(静)应急管危经许[2024]203441
| 沪(静)应急管危经许[2024]203441

