- 全部删除
 您的购物车当前为空
您的购物车当前为空
Science:首次解析帕金森病相关蛋白结构!或将带来新靶点!

Science 论文研究揭示了帕金森病相关蛋白的结构,或将为帕金森病治疗提供新的方向
帕金森病(Parkinson’s Disease, PD)是一种常见的神经退行性疾病,其特征是脑细胞的退化与死亡。
在健康个体中,每秒都有数不清的细胞死亡,并由新生细胞替代。然而,与大多数细胞不同,脑细胞一旦死亡,几乎无法再生,这使得神经退行性疾病的影响尤为严重。
线粒体损伤是帕金森病的核心病理机制之一。在健康个体中,当线粒体受损时,一种与线粒体自噬及帕金森病密切相关的蛋白激酶 PINK1(PARK6)会聚集在线粒体膜上,并通过泛素(ubiquitin)发出信号,指示细胞清除这些受损线粒体。然而,在帕金森病患者中,PINK1 发生突变后,其信号传导功能受损,会导致受损线粒体持续积累,最终引发脑细胞死亡。
但目前,人类 PINK1 的完整结构,以及 PINK1 如何在受损线粒体上稳定并激活仍未被全面揭示,尤其是包含帕金森病相关突变位点的结构仍然未知。
近期,WEHI 帕金森病研究中心的研究团队利用冷冻电镜技术,首次解析了结合在线粒体上的人类PINK1结构,并在Science期刊上发表了相关研究成果。这一突破性的发现或将为开发PINK1激活剂及帕金森病的治疗带来新的希望。


▲PINK1 稳定性及活性模型
人类PINK1 复合体的结构
该团队先是在人源细胞系中重建并纯化了 PINK1 复合体,以解析其在线粒体外膜(MOM)的稳定机制。具体流程如下:
1.PINK1过表达及线粒体去极化处理:
在 Expi293 人类细胞表达系统中,过表达 3xFLAG 标签的野生型人源PINK1。采用 寡霉素(Oligomycin) 和 抗霉素 A(Antimycin A)处理细胞,诱导线粒体去极化,使 PINK1 稳定积累在线粒体外膜上。
2.PINK1的纯化:
在分离出线粒体后,使用 Digitonin 溶解线粒体膜,提取出 膜结合PINK1 复合体。然后采用免疫共沉淀(IP) 方法,利用 FLAG 抗体 亲和纯化 PINK1 复合体,使用 尺寸排阻层析(SEC)进行分离,获得 PINK1 样本。
3.复合体成分分析:
采用 Western blot(WB)验证 PINK1 复合体的主要组成蛋白;活性实验评估 PINK1 复合体的功能完整性;质谱分析(Mass Spectrometry, MS)确定复合体的完整蛋白质组成;交联质谱(XL-MS)分析 PINK1 与 其他线粒体蛋白的相互作用位点,揭示 PINK1 进入线粒体通道的详细结构。
最终,通过冷冻电镜解析出了 PINK1 的高分辨率结构。

分析结果显示,人类 PINK1 并非独立存在,而是稳定结合在一个由 TOM 复合体(线粒体外膜转运复合体) 和 VDAC2(电压依赖性阴离子通道 2) 组成的超大分子复合体上。
小贴士
线粒体外膜(MOM)上的跨膜蛋白复合体在蛋白质转运、能量代谢和细胞凋亡等生理过程中起着关键作用。其中,转运通道复合体(TOM) 是线粒体蛋白质导入的主要入口,而电压依赖性阴离子通道(VDAC) 参与物质交换和细胞凋亡调控。
其稳定机制如下:
• TOM-VDAC复合体的核心结构
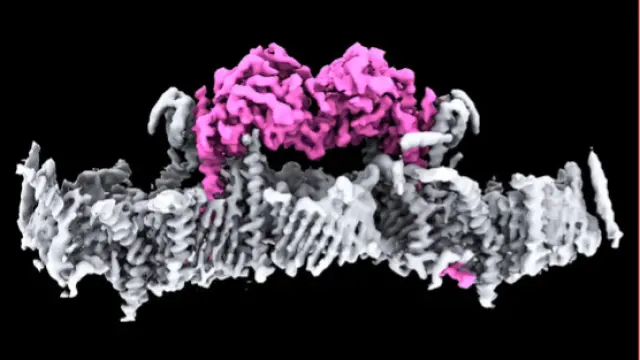
TOM-VDAC 复合体由两个对称的 TOM 核心复合体 组成,围绕一个 VDAC2 二聚体 对称排列。PINK1 结合在 VDAC2 上,并通过 TOM5、TOM20 和 TOM40 形成稳定的相互作用。
• 二聚体的形成
PINK1 以对称的 二聚体(dimer)形式存在,通过 Cys166 和 Cys125 两个关键的氨基酸残基形成二硫键,维持 PINK1 的稳定性和活性。
• 与TOM-VDAC复合体的相互作用
PINK1 通过其 C 端结构域与 TOM20 亚基结合,其 N 端被引导进入 TOM40 亚基通道,并在 TOM7 和 TOM22 的作用下穿过线粒体外膜,保证其稳定停留在线粒体外膜上。

▲二聚化的PINK1与TOM-VDAC结合的结构(沿膜平面展示)
此外,研究还揭示了 PINK1 的二聚化模式、激酶活性调控及泛素磷酸化前的过渡状态。为线粒体自噬的分子机制提供了新见解
总的来说,这一发现解释了 PINK1 在线粒体外膜上的稳定方式,并揭示了 TOM 复合体在 PINK1 信号传导中的关键作用。
小结
综上,该研究解析了人类 PINK1 在线粒体外膜上的稳定机制,并首次揭示了 TOM-VDAC 超大分子复合体 在 PINK1 维持与激活中的关键作用。
研究发现,VDAC2 通过与 TOM 复合体及 PINK1 直接相互作用,形成稳定的支撑平台,确保 PINK1 以特定构象停留在线粒体外膜,而非被完全转运入线粒体基质。此外,PINK1 在 TOM-VDAC 复合体上形成二聚体,并通过二硫键交联维持稳定,为其自磷酸化和泛素信号传递创造了理想条件。该研究不仅为 PINK1 介导的线粒体自噬 机制提供了结构基础,也为 帕金森病(PD)的靶向治疗 提供了潜在的新方向。
科研助力
帕金森病(Parkinson's disease,PD)是常见的慢性神经退行性运动障碍,影响着全球1%的70岁以上的人群,而现有的治疗方法仅仅在于处理其症状,但是不能延缓其进展。
根据抗PD 药物作用靶点可以分为多巴胺替代药物、多巴胺释放剂、单胺氧化酶-B(MAO-B)抑制剂、儿茶酚-O-甲基转移酶(COMT)抑制剂、多巴胺受体激动剂和辅助治疗药物(如抗胆碱能药物、抗组胺药物和抗抑郁药等)。
TargetMol 抗帕金森病化合物库 收集了857 种具有抗帕金森病活性的化合物及靶向帕金森病主要靶点的化合物,可用于相关的药物开发和药理研究。

往期推荐
• Cell重磅!发现新型GSDMD激动剂,可利用细胞焦亡治疗癌症
• Nat. Cancer:发现EGFR/PI3K双重靶向抑制剂——MTX531
• Breaking News!TargetMol官网全面升级,全方位提升您的使用体验!
• Science重磅!降解13种KRAS突变体,效力提升10倍!
参考资料:
https://medicalxpress.com/news/2025-03-scientists-decades-parkinson-mystery.html
原文链接:
https://www.science.org/doi/10.1126/science.adu6445
其他文章


订阅TargetMol新闻
科学新闻、观点和分析的重要汇总,每个工作日都会发送到您的收件箱.