- 全部删除
 您的购物车当前为空
您的购物车当前为空
Cell重磅!中国团队发现新型程序性细胞死亡方式

补体系统攻击红细胞,是一场简单的破坏战,还是一场有秩序的“内部崩塌”?
正常的红细胞寿命约是120天,但是因为各种异常原因,导致红细胞提前破裂、血红蛋白溢出,这种情况被称为红细胞溶解,简称溶血。
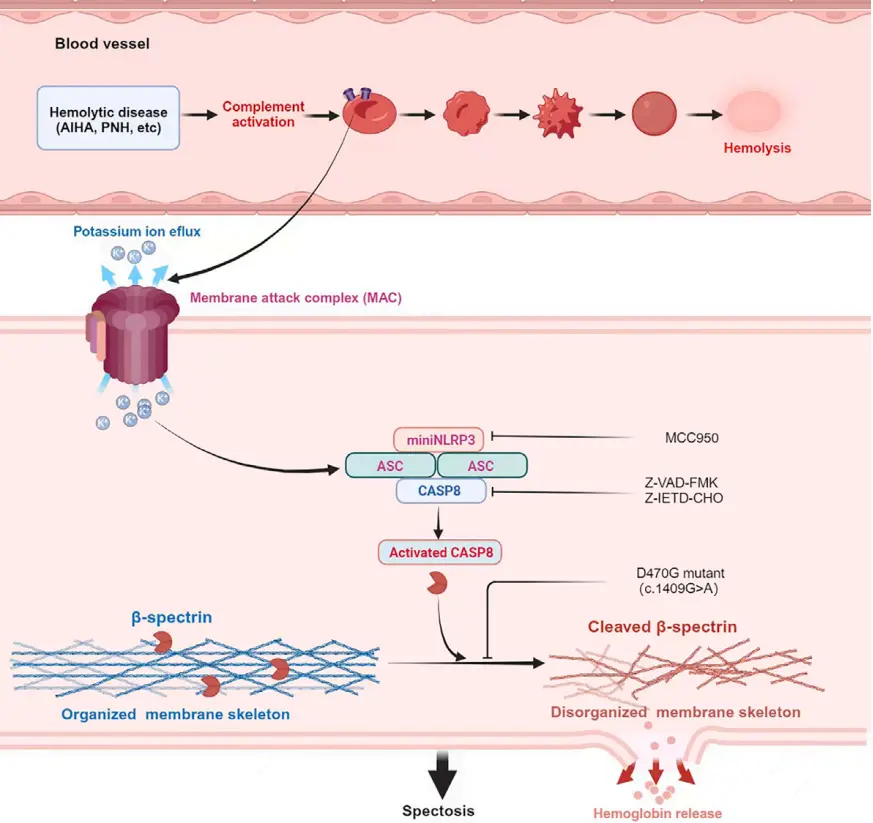
传统观点认为,ABO 血型抗原抗体反应激活补体,生成 C3a、C5a、C3b/iC3b 等产物并形成膜攻击复合物(MAC),在红细胞膜上打孔造成溶血。尽管近年来开发了补体抑制疗法,但其疗效并不稳定,因此,科学家们猜测或存在未知的溶血机制。
近期,华东理工大学刘琴教授团队联合空军军医大学附属西京医院胡兴斌副教授团队于 Cell 期刊发表了题为 Red blood cells undergo lytic programmed cell death involving NLRP3 的研究论文。
该研究以 ABO 血型反应活化补体的经典理论为起点,探讨了成熟红细胞在补体激活后的细胞内事件,揭示了 红细胞中存在一种全新的程序性细胞死亡方式——血影蛋白依赖性死亡(spectosis),为溶血性疾病的治疗开辟了新的方向。

红细胞程序性死亡
研究先是收集了纯化的人类成熟红细胞,并基于 ABO 血型抗原激活补体,构建了一个体外模型。观察发现,补体激活处理的红细胞经历了5个阶段性的形态变化,依次为:盘状细胞(discocytes)、棘状细胞I型(echinocytes I)、棘状细胞II型(echinocytes II)、球形细胞(spherocytes)和血影细胞(ghosts)。这些有序的形态变化表明,溶血过程可能涉及程序性细胞死亡(PCD)机制。
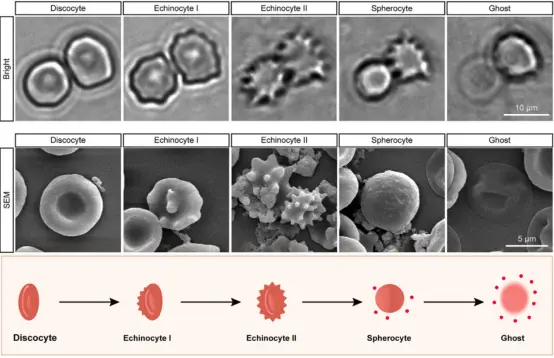
▲补体诱导溶血过程中的连续形态变化
在细胞程序性死亡过程中,胱天蛋白酶(caspase)发挥着关键的调控作用。为了探究 caspase 在溶血中的功能,研究者使用一系列 caspase 抑制剂进行了干预实验,结果发现,caspase-8 是补体诱导红细胞程序性死亡的关键因子。
caspase-8 可与一种截短形式的 NLRP3(miniNLRP3)组装形成 NLRP3-ASC-caspase-8 复合物。活化后的 caspase-8 直接催化血影蛋白β亚基(β-spectrin)的蛋白水解,破坏红细胞膜骨架,从而导致红细胞解体并引发溶血。
科研助力
血影蛋白(spectrin)是红细胞膜骨架的主要组成部分,由两条结构相似的亚基(β亚基和α亚基)构成。β-spectrin的N端含有肌动蛋白(F-actin)结合域,其裂解会导致β-spectrin与F-actin分离,最终破坏细胞骨架结构。
在这个过程中,使用 caspase-8 抑制剂 Z-IETD-FMK 或 miniNLRP3 抑制剂 MCC950 处理红细胞,可有效阻断 β-spectrin 的裂解过程。
为了进一步验证 β-spectrin 裂解在红细胞死亡中的功能性作用,研究者还利用腺嘌呤碱基编辑技术(ABE)在脐带血来源的 CD34⁺ 造血干细胞中构建了不可被 caspase-8 裂解的 β-spectrin 突变体(将IETD位点突变为IETG),并通过体外造血分化生成成熟红细胞。结果显示,突变型红细胞在补体刺激下,溶血(Hb释放)、ghost形成、β-spectrin裂解及骨架结构紊乱均显著减少,进一步证明 β-spectrin 裂解在补体介导的红细胞程序性死亡中至关重要。
基于这些发现,研究者提出了"spectosis"这一新术语,用于描述以 β-spectrin 裂解为核心机制、最终导致红细胞膜破裂的全新程序性细胞死亡形式。
临床验证
研究还证实了 spectosis 在临床补体相关溶血性疾病中确实发生。
在补体阳性自身免疫性溶血性贫血(AIHA)和阵发性睡眠性血红蛋白尿(PNH)患者的红细胞中,发现了 明显的形态学异常(如 ghost、echinocyte II 和 spherocyte 增加)、NLRP3-ASC-caspase-8 复合物的组装增加、红细胞骨架蛋白 F-actin 和 β-spectrin 分布紊乱,同时伴随 caspase-8 活化和 β-spectrin 裂解。
在急性溶血性输血反应(AHTR)小鼠模型中,通过人血浆诱导补体激活后,也观察到类似的 spectosis 激活现象。通过基因敲除(如 NLRP3–/–、ASC–/–、Casp8–/–)或突变(如 caspase-8 不可裂解的 β-spectrinIETG突变),显著抑制了补体引发的溶血和 spectosis。
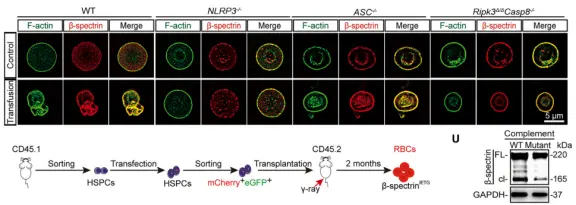
▲Spectosis介导小鼠中的补体诱导性溶血
而使用补体抑制剂(如Cp40 、Eculizumab )联合 spectosis 抑制剂(MCC950 、Z-IETD-FMK )显示出 协同治疗效果,提示靶向 spectosis 为补体介导溶血性疾病提供了新的治疗策略。
小结
综上,该研究发现补体诱导的溶血是一种依赖 caspase-8 的程序性红细胞死亡,并将这种细胞死亡定义为 spectosis,其特征为 miniNLRP3-ASC-caspase-8 复合物的组装、β-spectrin 的裂解和细胞骨架的破坏,以 spectosis 为靶点可能成为未来溶血性疾病治疗的新策略。
PS:TargetMol 可提供多种 caspase 抑制剂如 Z-VAD-FMK 、Cystamine ,以及 NLRP3 抑制剂 CY-09 、NLRP3-IN-13 等助力相关研究,欢迎私信噢~
往期推荐
• JAK 抑制剂联合疗法三期临床结果出炉,疗效 & 安全性俱佳!
• 新发现!铜螯合剂 TETA 治疗可帮助削弱肿瘤并增强免疫系统,使癌症治疗成功率提升40%!
• Breaking News!TargetMol官网全面升级,全方位提升您的使用体验!
• Science重磅!降解13种KRAS突变体,效力提升10倍!
原文链接:
https://www.cell.com/cell/abstract/S0092-8674(25)00389-7
其他文章


订阅TargetMol新闻
科学新闻、观点和分析的重要汇总,每个工作日都会发送到您的收件箱.