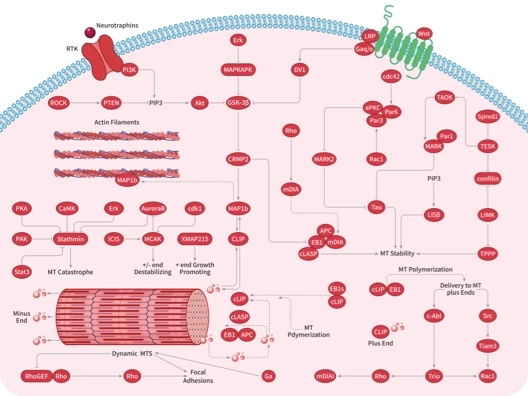
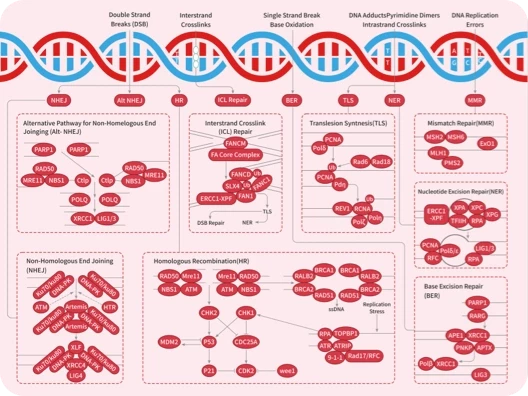
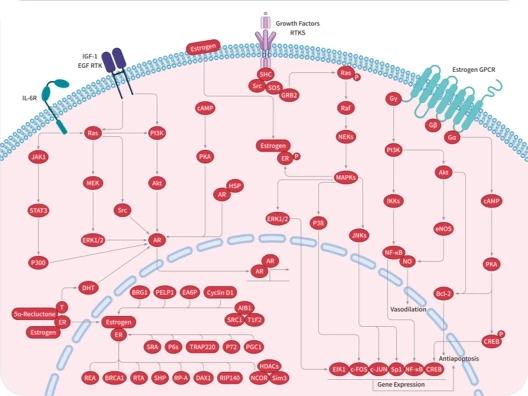
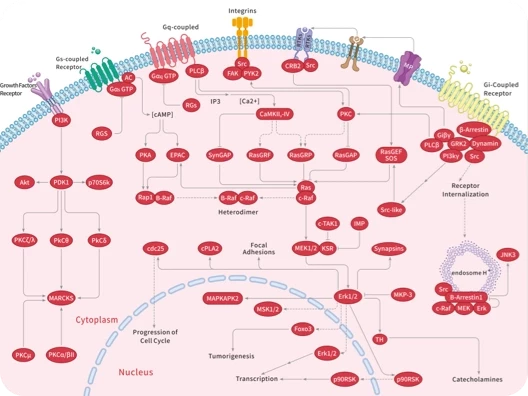
- 全部删除
 您的购物车当前为空
您的购物车当前为空

- 具有直观的搜索结果
- 更便捷高效地比较产品细节
- 快速、简洁的提交订单
- 成为我们TargetMol的一员,阅读和提交您的产品建议和意见
我们很想知道您的意见反馈,所以我们在每个页面上都梳理出一个反馈按钮。
铁死亡(Ferroptosis)是一种铁依赖性的调节性细胞死亡形式,由过度的脂质过氧化所引起,在肿瘤发生过程中,铁死亡具有促进和抑制肿瘤的双重作用。近些年,铁死亡已逐渐成为肿瘤治疗的新兴策略。
谷胱甘肽过氧化物酶4(GPX4)是铁死亡的主要抑制因子,对于防止细胞铁死亡至关重要。目前已研发了多种 GPX4 抑制剂,如RSL3、Fin56和ML210,以诱导癌细胞死亡。但这些抑制剂 不仅抑制 GPX4 的酶活性,还会导致免疫细胞中 GPX4 的降解,触发免疫细胞铁死亡,这可能损害抗肿瘤免疫。因此,我们需要寻找一种特异性的 GPX4 蛋白降解剂。
近日,一项发表于 Science Translational Medicine 的研究发现了一种特异性的新型小分子 N6F11(陶术限时五折促销~),通过激活 TRIM25 介导的 GPX4 降解影响癌细胞,而不干扰抗肿瘤免疫力。在胰腺癌小鼠模型中,N6F11 展现出显著的抗肿瘤活性。

▲原文截图
发现铁死亡诱导剂N6F11
在最新研究中,研究人员通过 In-Cell Western 技术,在 96 孔板上使用 4000+种未知生物活性的化合物处理了对铁死亡敏感的人胰腺癌细胞(PANC1),鉴定出了 N6F11 可作为有效的铁死亡诱导剂,引发 GPX4 的泛素化降解。
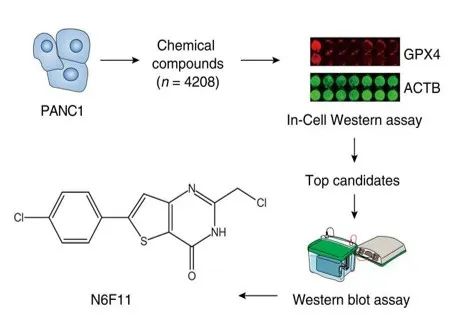
▲N6F11筛选流程
随后,研究人员深入探讨了 N6F11 触发 GPX4 降解以引发铁死亡的机制。
尽管 N6F11 在化学结构上与目前广泛使用的 GPX4 抑制剂 RSL3、Fin56 和 Erastin 没有相似之处,但它们均能导致 GPX4 蛋白降解。进一步的实验揭示了 N6F11 与其他铁死亡诱导剂的区别,即 N6F11 引发的 GPX4 蛋白降解与泛素化和脱泛素化过程密切相关。
此外,N6F11 诱导的 GPX4 蛋白降解不受蛋白酶体抑制剂的影响,而是通过细胞内 E3 连接酶 TRIM25 介导的早期泛素化触发 GPX4 的蛋白降解,而非通过自噬。相比之下,其他铁死亡抑制剂在此过程中会受到蛋白酶体抑制剂的调控。
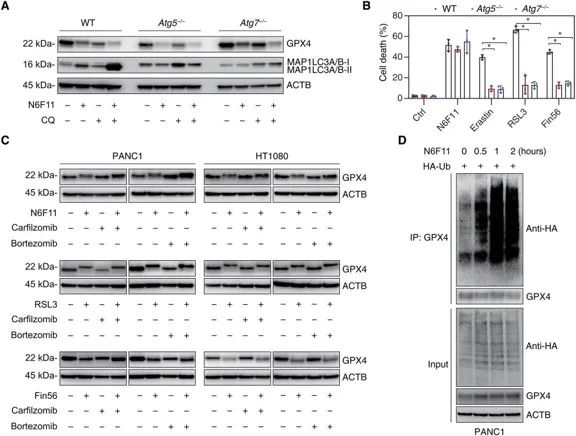
▲N6F11诱导的GPX4降解和铁死亡不需要自噬
值得注意的是,N6F11 必须与泛素化 E3 连接酶 TRIM25 的 PRY/SPRY(PS)结构域相结合才能引发 GPX4 的泛素化降解。因为 TRIM25 主要在肿瘤细胞中表达,在免疫细胞中很少见,所以 N6F11 可以选择性的在肿瘤细胞中触发 GPX4 降解以引发铁死亡,启动 T 细胞介导的抗肿瘤免疫,同时不会引起免疫细胞铁死亡。
进一步的 RNA 干扰和 CRISPR-Cas9 介导的 TRIM25 敲除试验还证明了 TRIM25 是唯一对 N6F11 具有选择性的 E3 连接酶,对其它 GPX4 抑制剂不敏感。
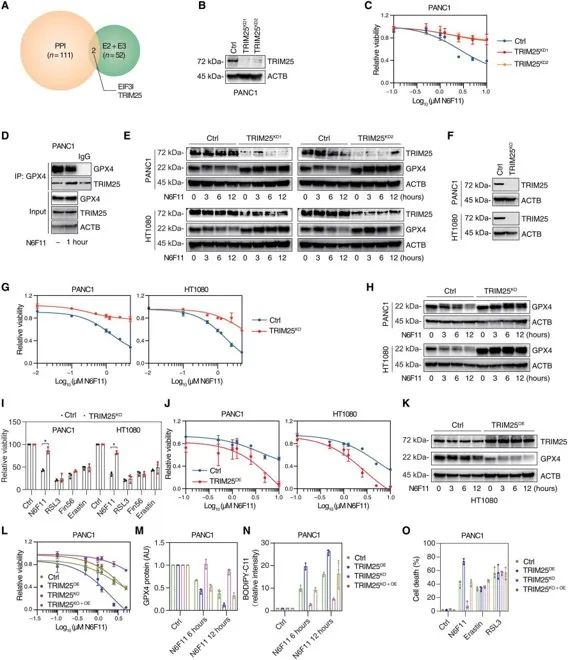
▲TRIM25介导N6F11诱导的GPX4降解和铁死亡
此外,研究人员还探讨了 N6F11 对肿瘤与适应性免疫系统之间的相互潜在作用。他们将 KPC 细胞皮下接种到免疫能力正常的 C57BL/6J 小鼠,在小鼠模型中,N6F11 通过抑制肿瘤生长、增加血清 HMGB1、诱导脂质过氧化以及减少 GPX4 蛋白水平显示出显著的抗肿瘤活性,明显延长了 KRAS 和 TP53 突变驱动的侵袭性胰腺癌的 KPC 小鼠的寿命。但 N6F11 的治疗效果在免疫受损小鼠中减弱,具体而言,CD8+ T 细胞耗竭和 HMGB1 中和抗体逆转了 N6F11 的抗癌活性,强调了适应性免疫细胞在肿瘤控制中的关键作用。
小结
综上,该研究发现了一种小分子 N6F11,可选择性诱导癌细胞发生铁死亡而不影响免疫细胞,从而抑制了已知铁死亡诱导剂的免疫抑制副作用。这种选择性效应是通过 TRIM25 介导的 GPX4 蛋白降解实现的。与目前在临床上使用的药物通过 caspase 依赖性凋亡引起癌细胞死亡不同,N6F11 通过间接策略抑制 GPX4,在肿瘤中引发铁死亡并激活强大的抗肿瘤免疫系统。在晚期肿瘤中,尤其是基因工程突变 KRAS/TP53 驱动的 PDAC 模型中,N6F11 与 CD274 靶向免疫疗法的联合应用具有潜在优势,但需要进一步的临床评估。
参考资料:
Jingbo Li et al. ,Tumor-specific GPX4 degradation enhances ferroptosis-initiated antitumor immune response in mouse models of pancreatic cancer.Sci. Transl. Med.15,eadg3049(2023).DOI:10.1126/scitranslmed.adg3049
其他文章



订阅TargetMol新闻
科学新闻、观点和分析的重要汇总,每个工作日都会发送到您的收件箱.

 嗨!有任何问题?点我咨询
嗨!有任何问题?点我咨询