- 全部删除
 您的购物车当前为空
您的购物车当前为空
免疫检查点(immune checkpoints)是调节免疫系统的关键分子,它们通过控制免疫反应的强度和持续时间,维持免疫系统的平衡。这些检查点通常起到“刹车”作用,防止免疫系统过度活跃,从而避免对自身组织的攻击,维持免疫耐受。
早在20世纪90年代,免疫学家James P. Allison和Tasuku Honjo分别发现了T细胞上的两种刹车分子——CTLA-4和PD-1,并提出免疫检查点抑制可重新激活T细胞,更有效地消灭癌细胞,因此获得了2018年的诺贝尔生理学或医学奖。越来越多的研究也显示,免疫检查点抑制剂(ICB)具有显著的治疗价值。
什么是PD-1/PD-L1通路?
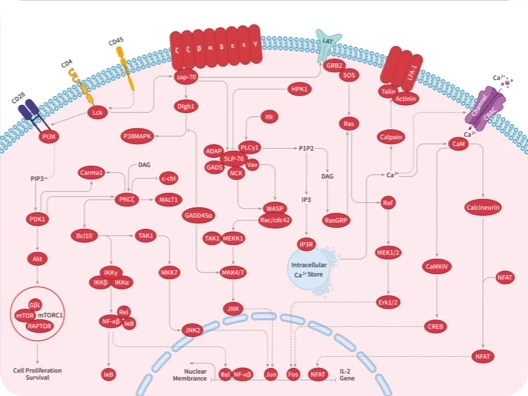
程序性死亡受体-1(PD-1 ;也称CD279)是免疫检查点之一,通过与其配体PD-L1(也称B7-H1/CD274)或PD-L2(也称B7-DC/CD273)的作用负责T细胞的激活、增殖和细胞毒性分泌,控制着肿瘤微环境中免疫耐受的诱导和维持。利用抗PD-1/PD-L1的单克隆抗体阻断PD-1/PD-L1信号通路,已在多种实体瘤中显示出卓越的抗肿瘤疗效。

PD-1的表达与调控
PD-1是一个55 kDa的跨膜蛋白,含有288个氨基酸,在1992年于缺乏白细胞介素-3(IL-3)的LyD9(小鼠造血祖细胞)和2B4-11(小鼠T细胞杂交瘤)细胞系中首次被发现,是一种适应性和先天免疫反应的抑制因子,主要在活化的T细胞、自然杀伤细胞(NK)、B淋巴细胞、巨噬细胞、树突状细胞(DC)以及单核细胞上表达。
在正常的生理条件下,T细胞几乎不表达PD-1,只有当T细胞长期暴露于抗原刺激被活化后,PD-1的表达才会被上调。这个过程由多种转录因子如NFAT、NOTCH、FOX 01和IRF9等调控,如果激活抗原被快速清除,PD-1水平会在响应的T细胞上降低。然而,如果抗原未被清除(如在慢性感染和癌症中),PD-1会持续高表达。
PD-L1的表达与调控
PD-L1是B7系列的一种33 kDa的I型跨膜糖蛋白,含有290个氨基酸。PD-L1通常由巨噬细胞、一些活化的T细胞和B细胞、树突状细胞(DCs)以及一些上皮细胞在炎症条件下表达。此外,肿瘤细胞也会表达PD-L1,作为一种“适应性免疫机制”以逃避抗肿瘤反应。
PD-L1的表达和调控机制非常复杂,涉及多种不同的因素以及信号通路。有研究把PD-L1的表达和调控大致分为了两类:
主要机制(非免疫驱动):包括
(1) 基因组异常:PD-L1的表达可由于基因的突变、扩增或重排导致。例如,某些肿瘤中存在的EML4-ALK融合基因可以通过MEK/ERK和PI3K/Akt信号通路上调PD-L1的表达。
(2) 基于microRNA的调控:microRNA可以通过结合到PD-L1的mRNA上调控其表达。例如,miR-142-5p可下调PD-L1的表达。
(3) 致癌转录因子和通路:MYC、STATs、NF-κB、HIF1α/2α等转录因子可以通过各种信号通路(如RAS/MEK/ERK,PI3K/Akt/mTOR,JAK/STATs和TLRs/IKKs)影响PD-L1的表达。
(4) 翻译后调控和转运:PD-L1的蛋白表达也受到翻译后修饰的调控,包括泛素化、去泛素化、磷酸化、糖基化和棕榈酰化。例如,GSK3β与PD-L1相互作用并诱导其磷酸化和随后的泛素化依赖性降解。
次要机制(免疫驱动):
主要由肿瘤微环境(TME)中的免疫细胞产生的可溶性因子驱动的炎症信号激活。
例如,多种可溶性细胞因子可以诱导PD-L1的表达,IFN-γ正是之一。早期研究指出,IFN-γ可以调控多种肿瘤类型、健康组织和免疫细胞中的PD-L1表达。
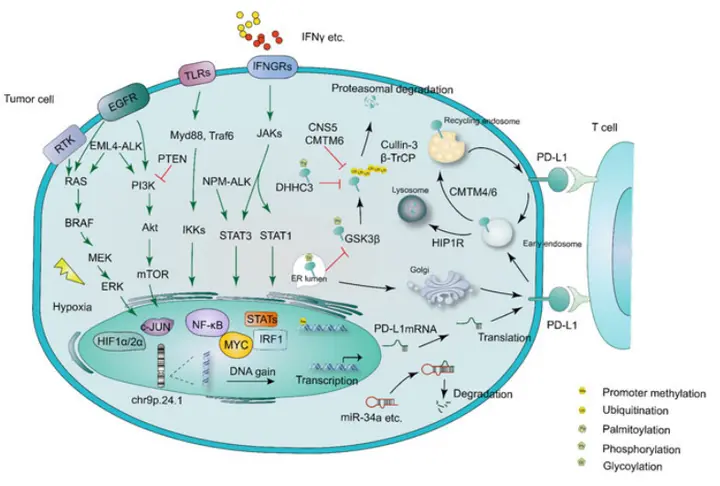
PD-L1的表达调控
PD-1/PD-L1通路如何实现免疫逃逸的机制?
许多肿瘤细胞上调PD-L1的表达,以应对宿主的免疫压力。PD-L1可以与T细胞上的PD-1结合,传递抑制性信号,使T细胞失去杀伤活性。
PD-1与PD-L1结合后,T细胞内的磷酸化事件会被抑制,影响TCR(T细胞受体)的信号传导。这导致T细胞活性降低,细胞周期停滞,甚至诱导T细胞凋亡。PD-1/PD-L1通路的活化还会抑制T细胞向肿瘤部位的迁移和浸润,使得肿瘤微环境中有效的T细胞数量减少。
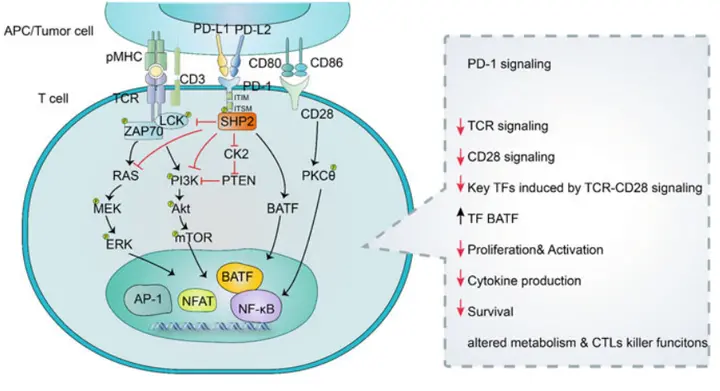
PD-1介导的T细胞抑制机制
具体来说,PD-L1/PD-L2与PD-1结合后,会招募磷酸酶SHP-2,削弱LCK诱导的ZAP70磷酸化,并减少RAS-MEK-ERK/PI3K-Akt-mTOR通路的活性。此外,PD-1的激活会诱导BATF的表达,抑制效应基因的表达。总体而言,PD-1信号通路导致T细胞的增殖、激活、效应功能和存活受到抑制。
PD-1/PD-L1抑制剂
目前已有多种PD-1/PD-L1抑制剂被发现在癌症中起着关键作用,例如:
pembrolizumab 是一种高度选择性的 IgG4-kappa 人源化单克隆抗体,靶向 PD-1 受体。它通过将一种高亲和力的小鼠抗人 PD-1 抗体的可变序列移植到含有稳定 S228P Fc 突变的人类 IgG4-kappa 同种型中生成。由默克公司开发,并于 2014 年 9 月 4 日获得 FDA 批准,用于治疗转移性恶性黑色素瘤,也是首个获得批准的 PD-1 抗体疗法。自首次批准以来,pembrolizumab 已获得批准用于治疗多种癌症。
nivolumab 是一种人源化 IgG4 抗体,靶向PD-1。该抗体最初在小鼠中完全生产,然后移植到人类的 kappa 和 IgG4 Fc 区域,并进行了 S228P 突变,以提高稳定性。
nivolumab 于 2014 年 12 月 22 日获得 FDA 批准上市。它也可以与 relatlimab 联合使用,品牌名为 Opdualag。
atezolizumab 能够阻断 PD-L1 与其受体 PD-1 和 B7.1 之间的相互作用,从而增强 T 细胞介导的抗肿瘤免疫。atezolizumab 单药治疗已获批准用于转移性尿路上皮癌(UC)和非小细胞肺癌(NSCLC)。
avelumab 能够结合PD-L1,阻断其与 T 细胞和抗原呈递细胞上受体的相互作用。avelumab 于 2017 年 3 月 23 日首次获得 FDA 批准。同年 9 月 18 日和 12 月 18 日,分别获得了欧洲药品管理局(EMA)和加拿大卫生部的批准。它用于治疗梅克尔细胞癌、转移性尿路上皮癌或肾细胞癌。
cemiplimab 通过阻断 PD-1,旨在增强 T 细胞介导的抗肿瘤反应。于 2018 年 9 月 28 日首次获得 FDA 批准,成为首个 FDA 批准用于治疗晚期皮肤鳞状细胞癌(CSCC)的药物。随后,它也获得了用于基底细胞癌和非小细胞肺癌的批准。2022 年 10 月,欧洲药品管理局(EMA)药品委员会(CHMP)推荐将 cemiplimab 批准用于治疗宫颈癌。
除此之外,TargetMol还可提供多种 PD-1/PD-L1抑制剂、抗体,助力您的研究,欢迎 私信咨询~

参考资料:
Ai L, Xu A, Xu J. Roles of PD-1/PD-L1 Pathway: Signaling, Cancer, and Beyond. Adv Exp Med Biol. 2020;1248:33-59. doi:10.1007/978-981-15-3266-5_3
Han Y, Liu D, Li L. PD-1/PD-L1 pathway: current researches in cancer. Am J Cancer Res. 2020;10(3):727-742. Published 2020 Mar 1.
Kleffel S, Posch C, Barthel SR, et al. Melanoma Cell-Intrinsic PD-1 Receptor Functions Promote Tumor Growth. Cell. 2015;162(6):1242-1256. doi:10.1016/j.cell.2015.08.052
Dong H, Strome SE, Salomao DR, Tamura H, Hirano F, Flies DB et al (2002) Tumor-associated B7-H1 promotes T-cell apoptosis: a potential mechanism of immune evasion. Nat Med 8:793–800
其他文章


订阅TargetMol新闻
科学新闻、观点和分析的重要汇总,每个工作日都会发送到您的收件箱.