- 全部删除
 您的购物车当前为空
您的购物车当前为空

细胞死亡的方式有很多种,表观遗传修饰通过调节与细胞死亡相关基因的表达水平,影响着细胞的生存与死亡。深入解析表观遗传修饰在肿瘤细胞死亡调控中的机制,不仅能为肿瘤治疗提供潜在靶点,还能显著提高肿瘤的治疗敏感性。
今天,T仔给大家分享一篇发表于Journal of Hematology & Oncology 的综述文章。来自陆军军医大学西南医院的研究团队探讨了表观遗传修饰在不同细胞死亡模式中的调控机制,重点讨论了近些年来发现的几种新型细胞死亡方式——焦亡(pyroptosis)、铁死亡(ferroptosis)、铜死亡(cuprotosis)和双硫死亡(disulfidptosis)。

细胞死亡与表观遗传修饰
细胞死亡可通过 基因程序化的自毁机制 实现,例如凋亡、坏死性凋亡和焦亡,也可能因 代谢失调 而触发,如铁死亡、铜死亡和双硫死亡。不同类型的细胞死亡通过多种信号通路,在肿瘤的发生、发展及耐药性调控中发挥着重要作用。
表观遗传学研究关注的是“非DNA序列变化”情况下,遗传信息通过特定机制或途径传递至后代。表观遗传修饰则主要参与关键细胞死亡蛋白的调控,并通过调控关键蛋白的表达水平来影响细胞死亡。
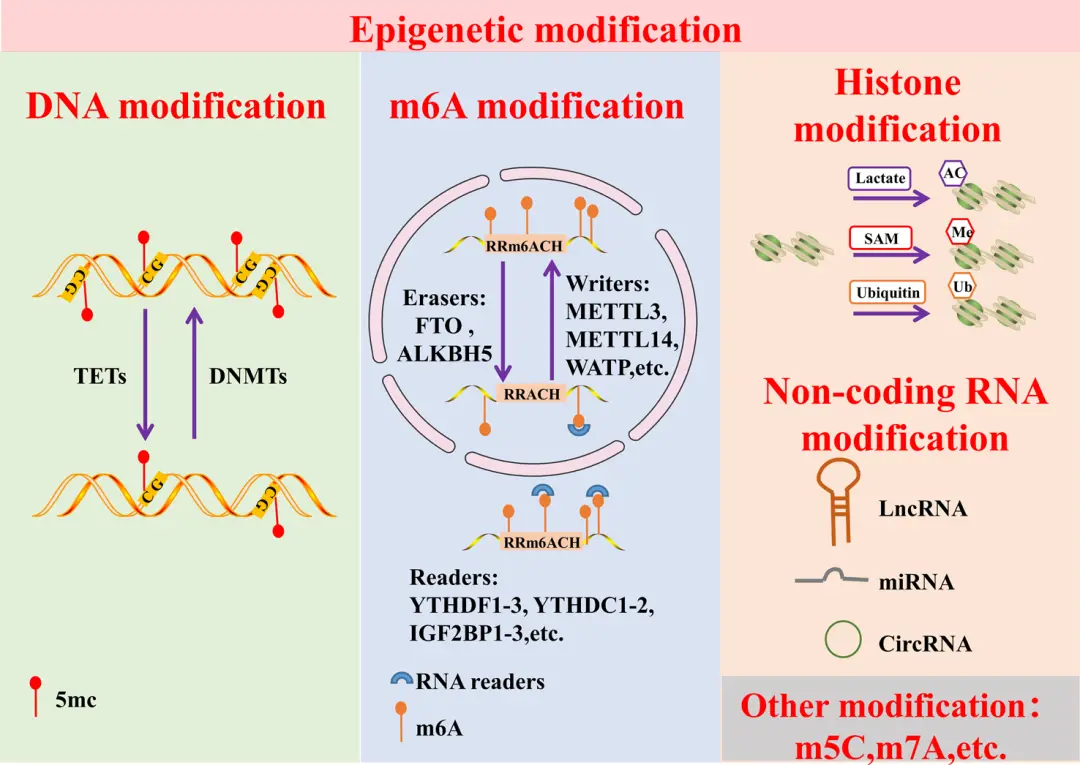
▲表观遗传修饰的分类
表观遗传修饰主要类型包括:
1)DNA甲基化:DNA甲基化修饰主要由两类酶共同调控:负责DNA去甲基化的四甲基胞嘧啶双加氧酶(TETs)和负责DNA甲基化的DNA甲基转移酶(DNMTs)。
2)N6-甲基腺苷(m6A):M6A修饰涉及三类协同作用的酶:writer(甲基转移酶)、 eraser(脱甲基酶)和reader(m6A 结合蛋白)。
3)组蛋白修饰:组蛋白修饰包括组蛋白乙酰化、组蛋白甲基化和组蛋白泛素化。
4)非编码RNA:包括miRNA、IncRNA、circRNA。
5)其它修饰类型:如RNA修饰中的 m5C修饰 和 m7G修饰。
不同细胞死亡模式下的表观遗传修饰
1)焦亡中的表观遗传修饰
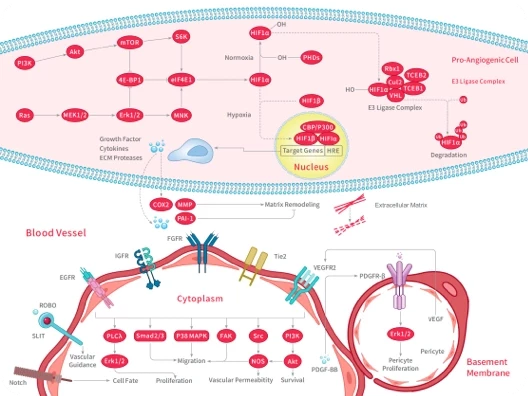
焦亡 是一种程序性细胞死亡,其特征是 细胞持续膨胀,最终导致细胞膜破裂并释放细胞内容物。这种死亡方式主要通过激活强烈的炎症反应参与多种生理和病理过程。
在细胞焦亡中,主要涉及五种炎性小体:NLRP3、AIM2、NLRP1、PYRIN和NLRC4,这些炎性小体通过 caspase 家族切割 GSDMD 和 GSDME 诱导焦亡,同时释放 IL-18 和 IL-1β。

▲细胞焦亡的机制
大量研究表明,细胞焦亡可以促进或抑制许多癌症的发生和转移,表观遗传修饰可以通过调节焦亡相关通路介导肿瘤生长和转移。
例如,DNA甲基化 在癌症中介导了ZDHHC1基因的下调,而上调ZDHHC1可以影响细胞代谢,并通过氧化应激介导的焦亡抑制肿瘤生长。一个典型的例子是,去甲基化药物 地西他滨 通过抑制 DNA 甲基化上调 GSDME 的表达,进而诱导黑色素瘤和 TNBC 细胞焦亡,激发抗肿瘤免疫。
m6A修饰也参与焦亡调控。在非小细胞肺癌(NSCLC)中,H3K4me1 和 H3K27Ac 的上调促进了 lncRNA LINC00969 的表达。LINC00969 通过与 METTL3 相互作用,依赖 m6A-YTHDF2 机制抑制 NLRP3,进而抑制细胞焦亡并促进耐药性。
2)铁死亡中的表观遗传修饰
铁死亡 是铁依赖性的磷脂过氧化驱动的⼀种细胞死亡⽅式,其机制涉及氧化还原稳态、铁代谢、线粒体活性,以及氨基酸、脂质、糖的代谢等过程。之前T仔介绍过不少关于铁死亡的文章,感兴趣的小伙伴可跳转查看哦~
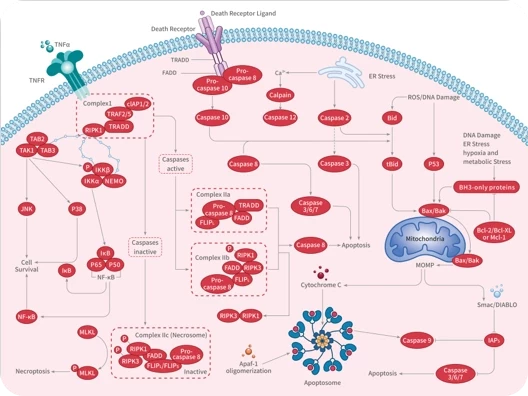
在铁死亡中,PUFA-PL(含多不饱和脂肪酸的磷脂) 合成、铁代谢以及线粒体代谢 可以引起脂质过氧化,进而诱导铁死亡。相反,GPX4-GSH系统 、FSP1-CoQH 系统 和 DHODH-CoQH2 系统 能抑制脂质过氧化的形成,从而抑制铁死亡。
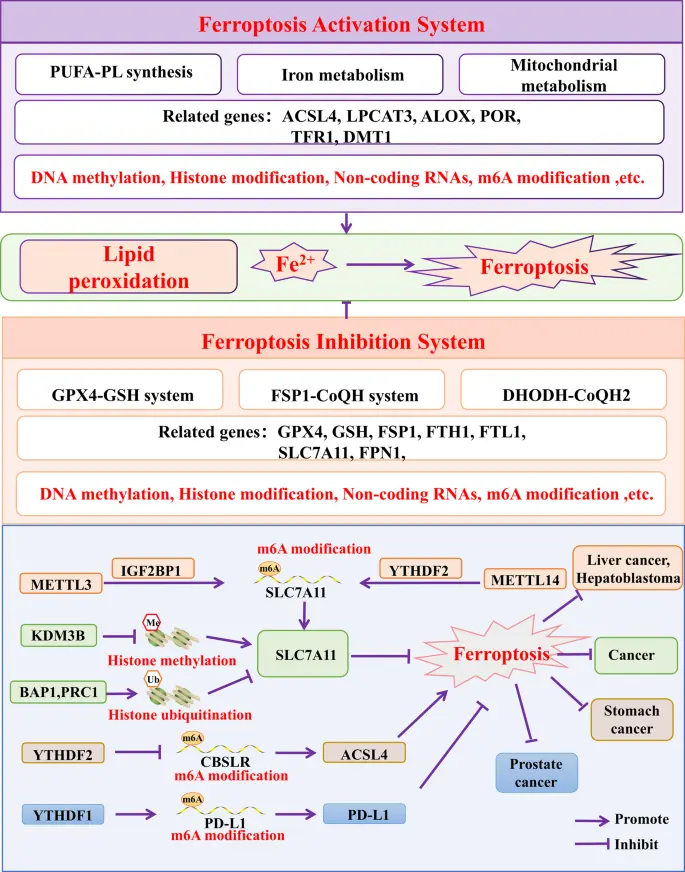
▲细胞铁死亡的机制
与铁死亡相关的蛋白包括 GPX4、ACSL4、SLC7A11、FTH1和FSP1。多种表观遗传调控方式(如DNA甲基化、m6A修饰、lncRNA调控)可以调节铁死亡相关基因的表达。
例如,H3K9 去甲基酶KDM3B 通过降低SLC7A11启动子甲基化水平促进其转录,而 BAP1和 PRC1 通过 H2A 去泛素化抑制 SLC7A11 的表达。SLC7A11 过表达通过抗氧化作用抑制铁死亡并推动肿瘤生长。此外,染色质重塑酶 LSH 通过 DNA 甲基化 和 lncRNA 调控下调铁死亡相关基因的表达,从而在肺癌和白血病中抑制铁死亡。
m6A 修饰同样参与铁死亡调控。低氧诱导的 lncRNA CBSLR 通过 YTHDF2 降低 ACSL4 蛋白稳定性,抑制胃癌细胞铁死亡并增强化疗耐药性。在前列腺癌中,YTHDF1 通过 m6A 修饰上调 PD-L1,抑制 CD8⁺ T 细胞毒性及免疫介导的铁死亡,导致不良预后。而在肝母细胞瘤中,METTL3 通过 IGF2BP1-m6A 途径促进 SLC7A11 表达,阻碍铁死亡;低氧环境下,HIF-1α 依赖性抑制 METTL14 表达,减少 SLC7A11 mRNA 的 m6A 修饰,在肝细胞癌中进一步抑制铁死亡。
3)铜死亡中的表观遗传修饰
铜死亡 是一种由过量铜离子触发的调节性细胞死亡形式,不同于其他细胞死亡途径,如细胞凋亡、铁死亡和焦亡等,铜死亡的主要过程 依赖于细胞内铜离子的积累。铜离子直接结合三羧酸循环(TCA)中的脂酰化成分,导致蛋白聚集、失调,阻断了三羧酸循环(TCA),并诱导细胞死亡。
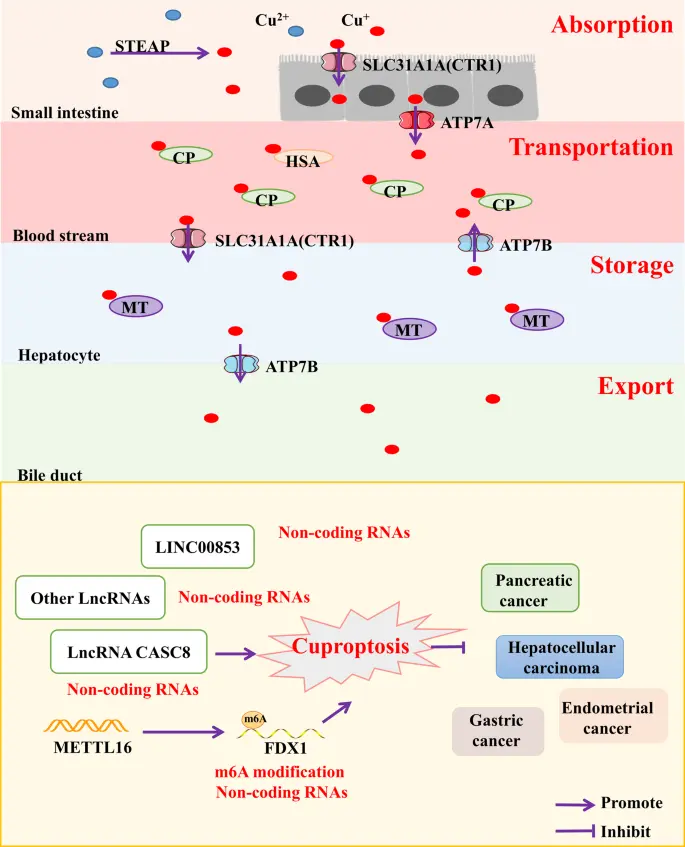
▲铜离子在人体内的代谢过程
目前的大部分研究聚焦于与 铜死亡相关的 lncRNA 在调控肿瘤代谢、增殖以及肿瘤微环境(TME)中的作用。
例如:
1.与铜死亡相关的 lncRNA LINC00853 通过增强胰腺癌细胞糖酵解和线粒体呼吸,促进细胞增殖和肿瘤生长。
2.另一种铜死亡相关的 lncRNA CASC8 在胰腺癌中高表达,与不良预后相关,其敲低能够抑制细胞增殖、迁移,并调节 TME 因子(如CD274和趋化因子CXCL)的表达。
此外,铜胁迫诱导METTL16在K229位点的乳酸修饰,提升 FDX1的m6A修饰水平,最终通过FDX1表达诱导胃癌中的铜死亡。尽管研究较少,但m6A修饰在肿瘤铜死亡中的调控作用展现出重要潜力,可能成为未来研究的热点领域。
4)双硫死亡中的表观遗传修饰
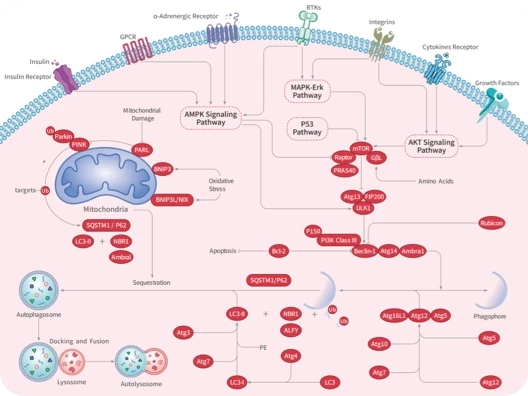
这是一种以细胞骨架蛋白崩解为特征的新型细胞死亡形式。在葡萄糖匮乏时,SLC7A11 高表达细胞内的 NADPH 会迅速耗竭,胱氨酸等二硫化物异常积累,从而诱发二硫化物应激 (disulfide stress) 和细胞快速死亡。
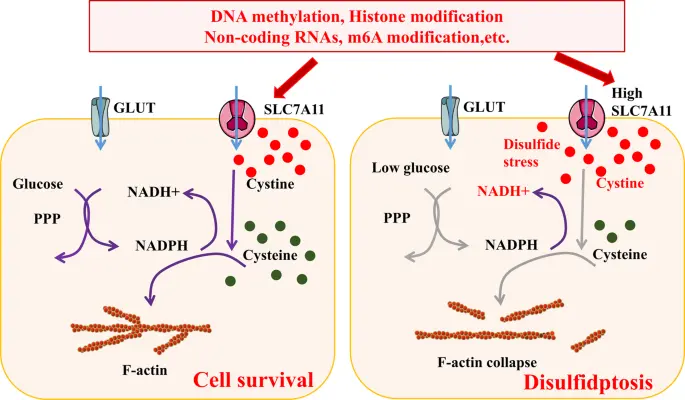
▲双硫死亡的机制
目前,双硫死亡的表观遗传修饰机制尚不完全清楚。
不过,有研究发现,与双硫死亡相关的 lncRNA 在乳腺癌亚型预测中具有重要价值,不同亚型中 lncRNA 的表达模式各异,例如 LINC02188 在基底样型中表达最高,而 LINC00511 在 Her2 阳性亚型中表达最高。
在宫颈癌中,部分与双硫死亡相关的 lncRNA(如ZSCAN16-AS1、AC083799.1)表现为保护因子,而另一些(如AC023043.1)则作为风险因子。具有较高双硫死亡相关 lncRNA 指数的患者对免疫治疗更敏感。
靶向细胞死亡途径进行癌症治疗
许多针对染色质和组蛋白修饰酶的小分子抑制剂已在临床上作为抗癌药物使用,例如DNA甲基转移酶(DNMT)抑制剂和组蛋白去乙酰化酶(HDAC)抑制剂。
1)DNMT抑制剂
常见的 DNMT 抑制剂包括 5-氮 杂 胞苷 和 地西 他 滨 。地西他滨通过激活 lncRNA PAS1 抑制人类透明质酸酶家族 PH20 的表达,从而导致乳腺癌生长和转移的抑制。还能促进卵巢癌患者对铂类治疗的敏感性;促进胶质母细胞瘤细胞中MHC I类新抗原的呈递,增强特异性T细胞的激活,从而促进其杀伤癌细胞。
而 DNA 甲基化抑制剂5-氮杂胞苷在体外和体内均能有效逆转前列腺癌抑制基因的表达和细胞生长,并增强抗癌药物 多西 他 赛 的抗癌功效。
2)HDAC抑制剂
HDAC抑制剂,如 SAHA 、Romidepsin 和 belinostat 已被FDA批准用于治疗某些类型的癌症,并能通过去除乙酰基来抑制肿瘤基因的转录和血管生成。此外,Panobinostat 被批准用于治疗多发性骨髓瘤,sulforaphane 可用于治疗结直肠癌,Vorinostat 可通过抑制低氧诱导因子(HIF)-1α和血管内皮生长因子(VEGF)在低氧条件下间接作用,最终阻止血管生成。
DNMT抑制剂和HDAC抑制剂也可联合应用。例如,5-氮杂胞苷(Aza)与TSA联合使用,可减轻内毒素引起的急性肺损伤中的炎症诱导的细胞焦亡。Aza还通过减少DNMT1的甲基化作用,抑制与心脏纤维化相关的NLRP3信号通路。Aza也通过铁自噬缓解糖尿病心肌缺血/再灌注损伤中的铁死亡。
3)其它抑制剂
此外,新型的喜树碱抗癌药物 FL118 通过激活 NLRP3-ASC-Caspase-1 通路诱导焦亡,有效抑制结直肠癌的生长和转移,其抗肿瘤活性显著优于临床常用药物Irinotecan 和 Topotecan 。同时,Simvastatin 和 Trichosanthin 也通过激活焦亡通路抑制肿瘤细胞增殖。
铁死亡诱导剂(FIN),如 Erastin 、Sulfasalazine 和 Sorafenib ,通过调控 SLC7A11 的表达,成功诱导多种癌症的铁死亡,展现出在癌症治疗中的巨大潜力。而铜死亡相关药物,如 Bortezomib 、Penicillamine 和 Trientine ,则通过调节细胞内铜离子浓度来诱导或抑制铜死亡。
细胞死亡之间的相互联系
不同的细胞死亡模式之间存在着复杂的相互联系,主要体现在以下几方面:
• 共享关键分子
例如,SLC7A11 通过上调 GPX4 表达减少脂质过氧化,从而抑制铁死亡,但同时也通过增强 NADPH 消耗促进双硫死亡。活性氧(ROS)作为多种细胞死亡的关键调控因子,其过量产生可诱导铁死亡、自噬、焦亡和凋亡。而 Ca²⁺的上调则能够促进自噬并抑制凋亡。
• 一种细胞死亡模式可以调控另一种模式的发生
例如,铜死亡通过促进 ROS 产生来调控其他细胞死亡。此外,过量的铜可通过激活 BAX 等 TP53 靶基因诱导 TP53 依赖性凋亡。同时,人脐带间充质干细胞来源的外泌体能够通过 miR-146a-5p/TRAF6 途径上调自噬水平,从而抑制细胞焦亡。
• 同一种刺激可诱导不同形式的细胞死亡
同一刺激在不同强度和特定条件下可能触发不同的细胞死亡形式。例如,P53 既能促进凋亡,也能诱导铁死亡;SLC7A11 一方面抑制铁死亡,另一方面却促进双硫死亡。而 Ca²⁺的上调既可增强自噬,又能抑制凋亡。
这种复杂的相互作用为我们更深入理解细胞死亡机制和开发创新抗癌疗法提供了重要的研究视角。
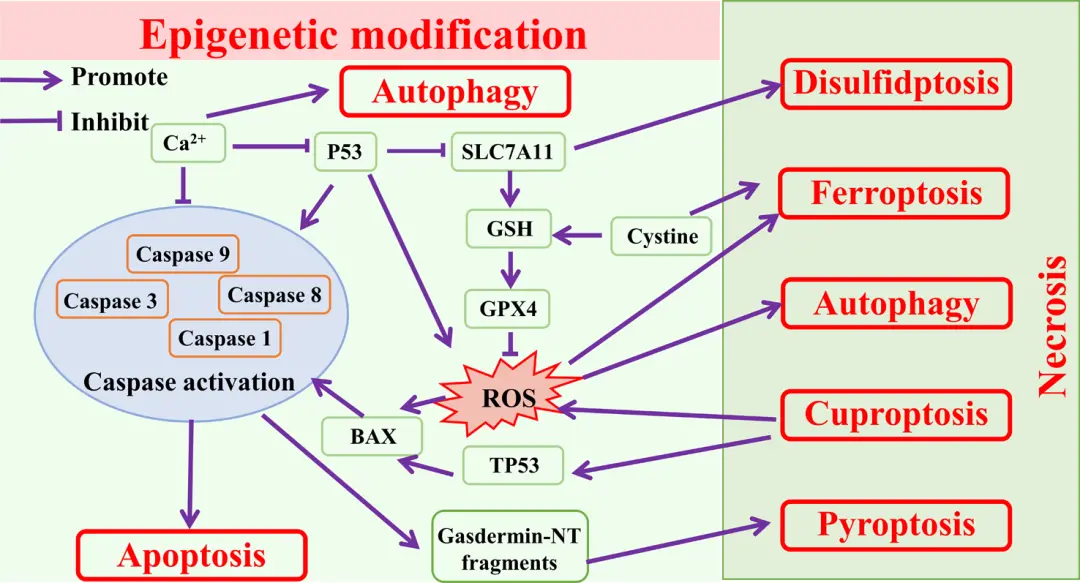
▲不同细胞死亡模式之间的联系
小结
表观遗传学主要研究“表观遗传现象”的机制,包括:基因选择性转录的调控,有DNA 甲基化、基因印记、组蛋白共价修饰和染色质重塑;和基因转录后的调控,有基因组中非编码RNA、微小RNA、反义RNA、内含子及核糖开关等。
表征遗传具有解释老化机制、人类发育和癌症起源等疾病的潜力。例如,文献报道原癌基因区的表征遗传控制和肿瘤抑制序列可通过组蛋白构象变化而直接影响癌症的形成和进展。
TargetMol可为您提供细胞焦亡、铁死亡、铜死亡以及双硫死亡的各种抑制剂、诱导剂,除此之外,还为您提供TargetMol 表 观遗传库 ,该库收集了1,090 种表观遗传相关的活性小分子,适用于表观遗传学研究,可用于高通量、高内涵筛选。

原文链接:
https://jhoonline.biomedcentral.com/articles/10.1186/s13045-024-01545-6#Sec15
其他文章


订阅TargetMol新闻
科学新闻、观点和分析的重要汇总,每个工作日都会发送到您的收件箱.