- 全部删除
 您的购物车当前为空
您的购物车当前为空
购物车
<div style = 'overflow: hidden; width: 100%; height: auto; display: inline-block;'><div class="text-dsp">
<div class="vblock zh">
<div style="margin: 0 auto;">
<p><img style="display: block; margin-left: auto; margin-right: auto;;width: 100%" src="https://cdn.targetmol.cn/group3/M00/3E/F6/CgoaEWbQQoiEemCwAAAAAONaePA537.png" alt="IMG_256"></p>
<p><a href="https://www.targetmol.cn/compound/Gemcitabine">吉西他滨</a><a href="https://www.targetmol.cn/compound/Gemcitabine">(</a><a href="https://www.targetmol.cn/compound/Gemcitabine">Gemcitabine</a><a href="https://www.targetmol.cn/compound/Gemcitabine">)</a>是一种常见的嘧啶核苷类似物抗代谢药和抗肿瘤剂,能靶向抑制DNA 合成,导致细胞自噬 (autophagy) 和凋亡 (apoptosis)。</p>
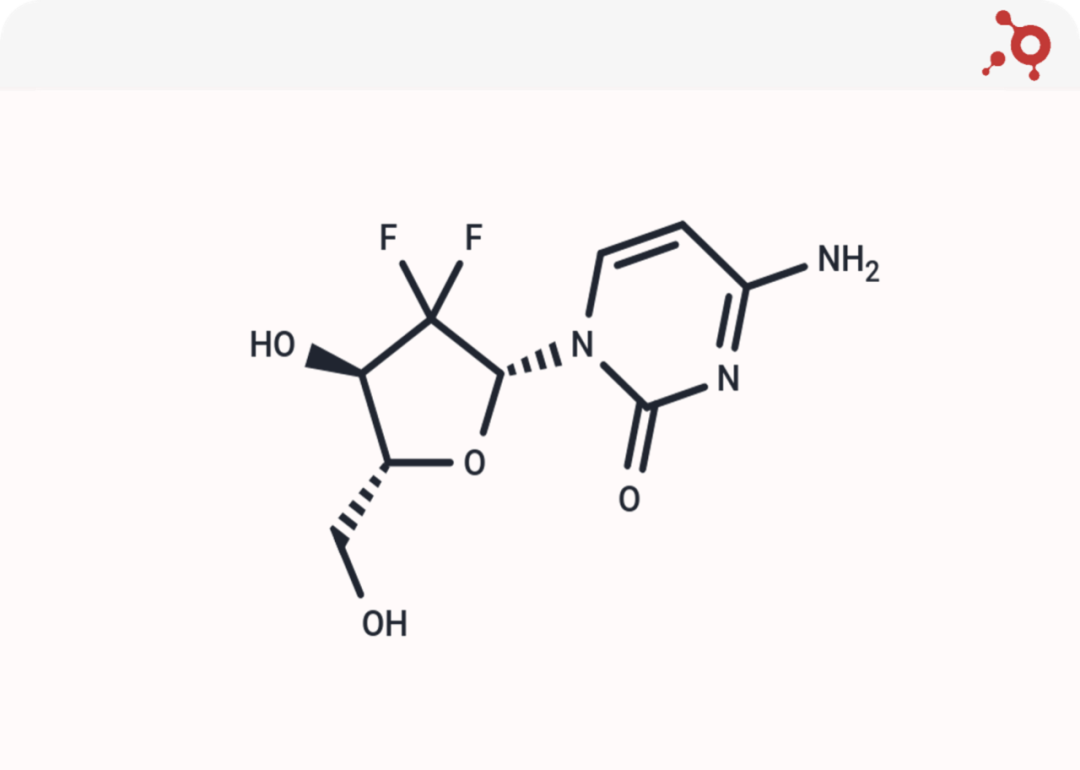
<p>吉西他滨的化学式为C9H11F2N3O4;核心结构是氟代基团(特别是二氟代修饰)和氨基基团,这两个官能团决定了吉西他滨的药理活性和稳定性;基于氨基基团的前药设计和开发也是当前的热门研究方向。</p>
<p><img style="display: block; margin-left: auto; margin-right: auto;" src="https://cdn.targetmol.cn/group3/M00/3E/FA/CgoaEGbQQoiEYYU1AAAAAKR7HKs452.png" alt="IMG_259"></p>
<p style="text-align: center;">▲Gemcitabine化学结构式</p>
<p><strong>作用机制</strong></p>
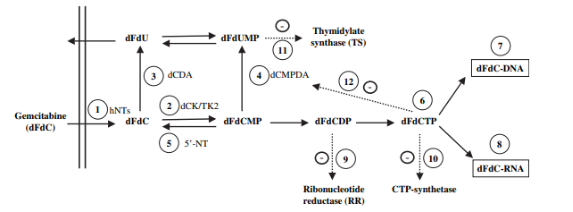
<p>Ⅰ.与阿糖胞苷类似,Gemcitabine在细胞内被活化后,其主要代谢物能够掺入DNA中,特别是在G1/S期,这一细胞周期的关键阶段,使肿瘤细胞无法完成正常的生命周期,进而引发细胞自噬,从而有效阻断肿瘤细胞的增殖。</p>
<p>Ⅱ.Gemcitabine还具有独特的自我增效作用。它能够抑制脱氧胞嘧啶脱氨酶,减少细胞内代谢物的降解,进一步提升其抗肿瘤效果。同时,Gemcitabine还能抑制核苷酸还原酶,导致细胞内脱氧核苷三磷酸酯减少,进一步削弱肿瘤细胞的生存能力。</p>
<p>Ⅲ.Gemcitabine 可以通过联合用药增强其抗肿瘤效果,如Gemcitabine可与膳食制剂吲哚-3-甲醇 (I3C)联合使用通过显著上调 hENT1 表达能增强在胰腺细胞系中的疗效<sup>[1] </sup>;</p>
<p><img style="display: block; margin-left: auto; margin-right: auto;" src="https://cdn.targetmol.cn/group3/M00/3E/FA/CgoaEGbQQoiEE4XmAAAAAMDKKqw448.png" alt="IMG_260"></p>
<p style="text-align: center;">▲Gemcitabine 的细胞药理学<sup>[2] </sup></p>
<p><strong>明星分子限时半价</strong> </p>
<p><img style="display: block; margin-left: auto; margin-right: auto;" src="https://cdn.targetmol.cn/group3/M00/3E/F6/CgoaEWbQQoiEBDyoAAAAACJWm9A092.png" alt="IMG_261"></p>
<p style="text-align: center;">▲点击前往官网下单</p>
<p style="text-align: center;"> </p>
<p> </p>
<p><span style="font-size: 24pt;"><strong>适用研究方向</strong></span></p>
<h2><strong>胰腺癌治疗相关研究</strong></h2>
<p>Gemcitabine 是胰腺癌研究领域的热门试剂。</p>
<p>胰腺癌作为“癌王” ,难以诊断治疗,造成很多患者确诊后即在短时间内死亡。因此,关于胰腺癌的相关研究热度一直居高不下。</p>
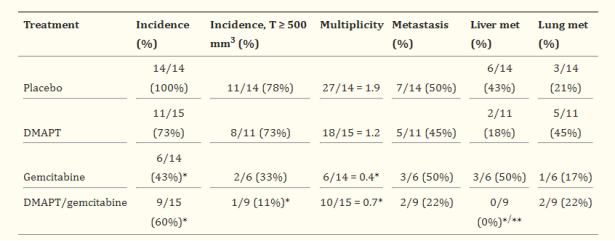
<p>有研究表明,DMAPT(二甲氨基小白菊内酯 )治疗(73%)、吉西他滨治疗(43%)以及两者联合治疗(60%)可显著降低肿瘤发病率,并且MAPT和吉西他滨的联合治疗比单一药物更有效,可显著提高胰腺癌的中位生存期,减小胰腺肿瘤的体积,降低肝转移的发生率<sup>[3] </sup>。</p>
<p><img style="display: block; margin-left: auto; margin-right: auto;" src="https://cdn.targetmol.cn/group3/M00/3E/F6/CgoaEWbQQomEZByCAAAAAC5ss6E299.png" alt="IMG_262"></p>
<p style="text-align: center;">▲不同治疗方式对胰腺肿瘤的发病率、多样性和转移的影响<sup>[3] </sup></p>
<h2><strong>靶向前药的设计开发</strong></h2>
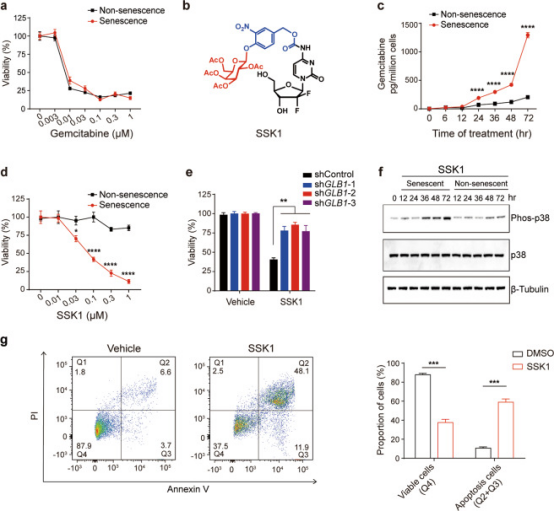
<p>由于 4-氨基官能团被广泛用于前药开发,因此基于吉西他滨的结构的特殊性以及良好的药理活性(可有效杀死小鼠和人类衰老细胞;全身毒性较低),开发出了衰老特异性杀伤化合物1(SSK1);通过β-半乳糖苷酶的靶向前药SSK1可以消除衰老细胞,减轻炎症并恢复老年小鼠的身体功能。</p>
<p><img style="display: block; margin-left: auto; margin-right: auto;" src="https://cdn.targetmol.cn/group3/M00/3E/FA/CgoaEGbQQomEe8ygAAAAAE91ecw938.png" alt="IMG_263"></p>
<p style="text-align: center;">▲基于吉西他滨SSK1 的设计并验证其选择性杀死衰老细胞的能力<sup>[4] </sup></p>
<h2><strong>耐药性机制研究</strong></h2>
<p>吉西他滨与其他药物如奥沙利铂、伊立替康、miR-345、白蛋白结合型紫杉醇、RT11-i抗体、二甲双胍、银杏内酯B和褪黑素联合使用,已被证明能够增强吉西他滨在胰腺癌治疗中的疗效。</p>
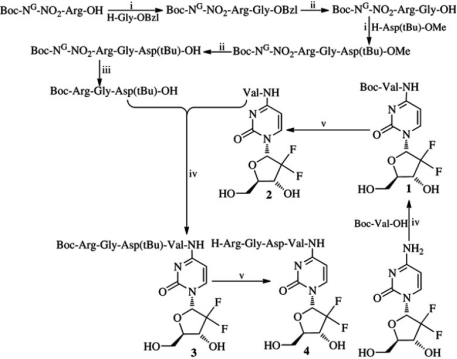
<p>无论是作为一线化疗药物还是二线化疗方案的一部分,吉西他滨都得到了广泛的应用。但由于Gemcitabine的耐药性、半衰期短以及和副作用严重降低吉西他滨的化疗效果,催生了Gemcitabine衍生物、药物载体递送系统以及其相关耐药机制的研究。如下图,基于纳米技术合成的RGDV-吉西他滨克服了吉西他滨的耐药性以及肝肾毒性,具备纳米特征以及不错的体内外抗肿瘤活性。</p>
<p><img style="display: block; margin-left: auto; margin-right: auto;" src="https://cdn.targetmol.cn/group3/M00/3E/FA/CgoaEGbQQomEEZW2AAAAABA66eA634.png" alt="IMG_264"></p>
<p style="text-align: center;">▲RGDV-吉西他滨的合成路线<sup>[5] </sup></p>
<h2><strong>抗病毒研究</strong></h2>
<p>2022年国内批准的新冠口服药阿兹夫定其本质就是核苷类似物,其作用机制为<strong>模仿病毒RNA中的核苷酸来干扰病毒的RNA合成过程,从而起到抗病毒的作用。</strong>美国批准用于治疗新冠的Molnupiravir也是一种核苷类似物。它在病毒RNA合成过程中被掺入到病毒RNA链中,导致病毒RNA的错误率增加,从而抑制病毒的复制。</p>
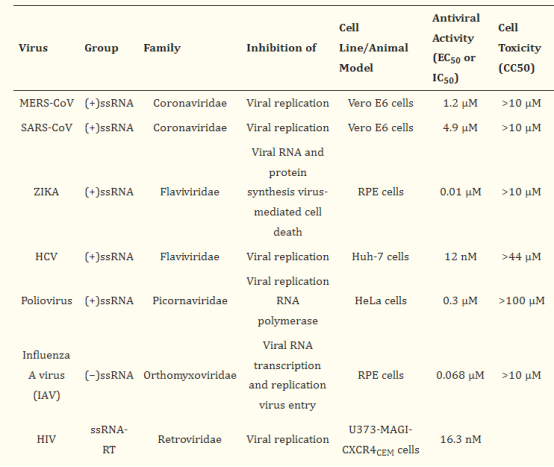
<p>Gemcitabine 作为一种核苷类似物,同样具有抗病毒活性。目前已经验证其对 SARS-冠状病毒、寨卡病毒、丙型肝炎病毒和脊髓灰质炎病毒等多种病毒具有抑制活性。</p>
<p><img style="display: block; margin-left: auto; margin-right: auto;" src="https://cdn.targetmol.cn/group3/M00/3E/F6/CgoaEWbQQomEKkOnAAAAAIg5VMM201.png" alt="IMG_265"></p>
<p style="text-align: center;">▲吉西他滨的广谱抗病毒活性<sup>[6] </sup></p>
</div>
<p>参考资料:</p>
<p>[1]Wang H,et, al. Enhanced efficacy of gemcitabine by indole-3-carbinol in pancreatic cell lines: the role of human equilibrative nucleoside transporter 1. Anticancer Res. 2011 Oct;31(10):3171-80.</p>
<p>[2]Mini E, et, al. Cellular pharmacology of gemcitabine. Ann Oncol. 2006 May;17 Suppl 5:v7-12. </p>
<p>[3]Yip-Schneider MT,et, al. Dimethylaminoparthenolide and gemcitabine: a survival study using a genetically engineered mouse model of pancreatic cancer. BMC Cancer. 2013 Apr 17;13:194. </p>
<p>[4]Cai Y,et, al. Elimination of senescent cells by β-galactosidase-targeted prodrug attenuates inflammation and restores physical function in aged mice. Cell Res. 2020 Jul;30(7):574-589. </p>
<p>[5]Liu W, et, al. RGDV-modified gemcitabine: a nano-medicine capable of prolonging half-life, overcoming resistance and eliminating bone marrow toxicity of gemcitabine. Int J Nanomedicine. 2019 Sep 6;14:7263-7279. </p>
<p>[6]Shin HJ, et, al. Gemcitabine and Nucleos(t)ide Synthesis Inhibitors Are Broad-Spectrum Antiviral Drugs that Activate Innate Immunity. Viruses. 2018 Apr 20;10(4):211.</p>
</div>
</div>
<div style="height: 50px;"></div></div> 


其他文章
面对压力很崩溃?可能真不是你的问题,Nature子刊发现抗压的关键蛋白2025-03-26

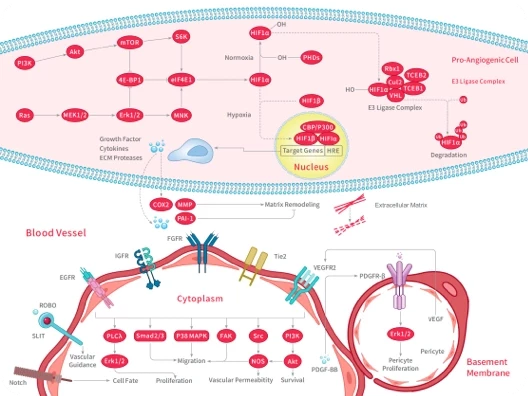
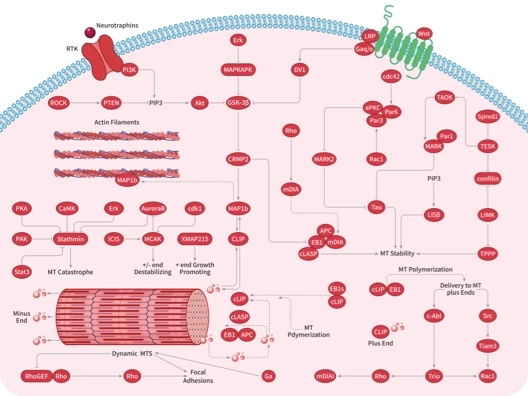
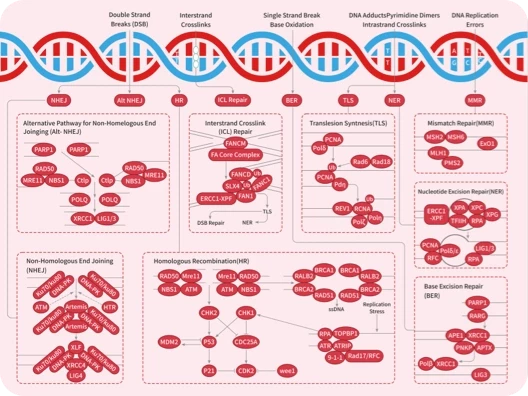
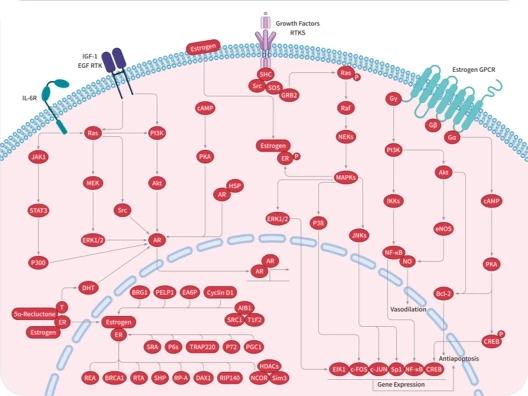
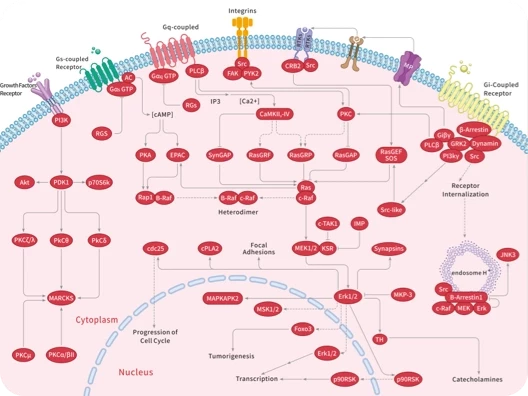
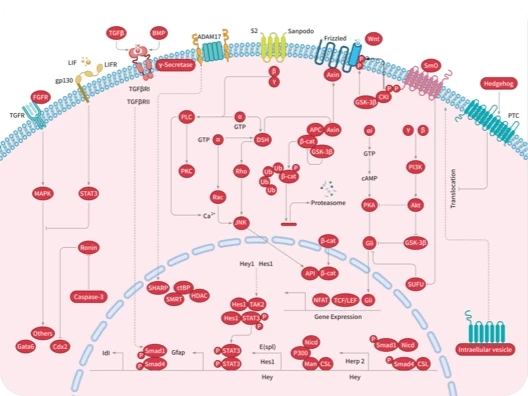
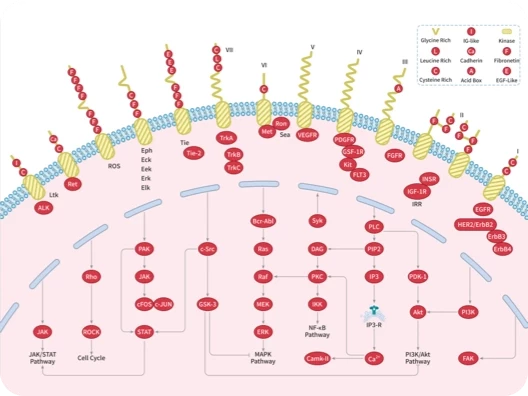
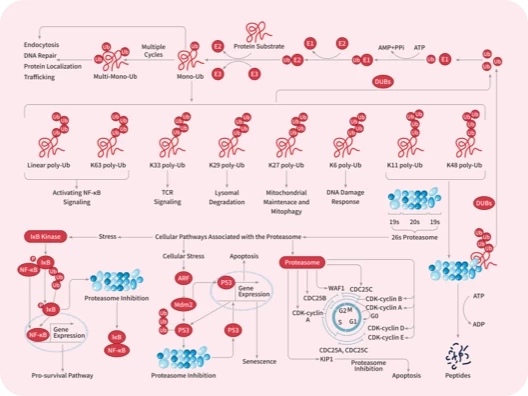
科研资讯:Angiogenesis 信号通路组成/激活机制/功能作用2025-03-24

下一代CDK4/6抑制剂——Atirmociclib有什么特点?2025-03-24

心血管疾病研究产品指南2025-03-20

订阅TargetMol新闻
科学新闻、观点和分析的重要汇总,每个工作日都会发送到您的收件箱.