- 全部删除
 您的购物车当前为空
您的购物车当前为空

超过30种 KRAS 疗法正在临床评估,“不可成药靶点”已成为过去式。
KRAS是一种小鸟苷三磷酸酶(GTPase),在活性鸟苷三磷酸(GTP)结合状态和非活性鸟苷二磷酸(GDP)结合状态之间循环。活性 KRAS 通过与多种效应蛋白结合并激活它们来调控细胞的生长和增殖。

▲在正常细胞中,KRAS主要与GDP结合,处于非活跃状态。而与癌症相关的突变KRAS对GAP不敏感,持续与GTP结合,从而导致下游效应器的长期结合和激活。
KRAS 突变是导致癌症发展和转移的主要驱动因素之一,曾被认为是“不可成药”的靶点。然而,Sotorasib 和 adagrasib 的开发打破了这一观点,这两种药物阻断了特定 KRAS 突变体 KRAS G12C的活性。
KRAS G12C抑制剂的成功也激励了科学界继续开发针对其他 KRAS 突变体的抑制剂,尤其是KRAS G12D(最常见的KRAS突变之一)。目前,至少有 9 种 KRAS G12D选择性抑制剂处于临床试验阶段,包括:ASP3082、ASP4396、GFH375/VS-7375、INCB16173、TSN1611、QTX3046、RMC-9805 、MRTX1133 (点击跳转TargetMol明星分子——MRTX1133 ) 和 HRS-4642 (点击跳转发现首个临床KRAS G12D抑制剂——HRS-4642 )。
与此同时,也有科学家试图设计一种能够降解多种 KRAS 突变体的泛 KRAS 疗法。如近期,Boehringer-Ingelheim 与英国邓迪大学的合作团队开发的一种名为 ACBI3 的 PROTAC 分子,能够 有效降解并失活 17 种常见 KRAS 突变体中的 13种——包括癌症中出现频率最高的 KRAS G12D,相关内容已发表于Science。

ACBI3可降解并灭活17种常见KRAS突变体中的13种
该团队在一种可以抑制多数 KRAS 突变体的非共价抑制剂 BI-2865 的基础上,将 BI-2865 的 SIIP 结合基序与连接子相结合,并连接到 Von Hippel-Lindau (VHL) E3 连接酶的已建立结合基序,优化了 VHL:PROTAC:KRAS 三元复合物的稳定性和耐久性,由此得到了 ACBI3 。
PS:关于BI2865,T仔也写过相关的介绍文章:Nature重磅丨“不可成药”靶点又一新突破!可抑制98%KRAS驱动癌症 。
现有的 KRAS 抑制剂通常是通过与突变的KRAS蛋白结合来抑制其功能,ACBI3 则通过降解目标蛋白来实现更强的抑制效果。

▲VHL-PROTAC-KRAS三元复合物结构
细胞实验显示,ACBI3 在多种 KRAS 突变细胞系(如GP2d、SW620和NCI-H358,分别表达KRAS G12D、KRAS G12V或KRAS G12C)中的抑制效果比非降解类 KRAS 抑制剂高出10倍以上,可引发显著的 G1/G0 期细胞周期阻滞,抑制细胞增殖,并且可以长期抑制下游的信号传导、产生更持久的抑癌效果。

▲ACBI3结构
小鼠实验显示,ACBI3 能够在体内有效降解致癌 KRAS 蛋白,显著抑制 KRAS G12D突变型结直肠癌和 KRAS G12V 突变型卵巢平滑肌肉瘤细胞系的小鼠移植瘤模型中的肿瘤生长。
总体而言,ACBI3 是一种高度选择性、强效的泛 KRAS 降解剂,能够靶向多种 KRAS 突变,其效力比传统靶向抑制剂提高了 10 倍以上,并且可以长期抑制下游的信号传导、产生更持久的抑癌效果。在体外和体内实验中,ACBI3 均表现出强效的抗肿瘤活性,能够有效抑制 KRAS 突变细胞的增殖,并导致肿瘤显著消退。
同样,在今年 6 月 28 日一项发表于 Cell Discovery 的研究中,中山大学肿瘤医院曾木圣团队曾开发了一种肿瘤靶向 KRAS 降解剂(TKD),可有效靶向多种 KRAS 突变体。

TKD具有良好的药代动力学特性且无明显副作用,具有显著的抗肿瘤效果
TKD(tumor-targeting KRAS degradation)由 KRAS 结合纳米抗体、选择性靶向癌细胞的细胞穿透肽(Cell-penetrating peptide,CPP)和 CTM 组成。这种设计使 TKD 能够有效地与癌细胞中的 KRAS 结合并促进其降解。
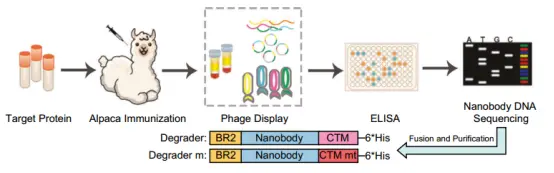
▲TKD构建流程
先前的研究表明,KRAS 突变会抑制干扰素调节因子2(IRF2)的表达,IRF2 是一种转录因子,能够阻止骨髓来源抑制细胞(MDSCs)迁移至肿瘤微环境,并促进程序性死亡配体1(PD-L1)的表达,从而在肿瘤中形成免疫抑制微环境。
鉴于 TKD 显著诱导突变KRAS的降解,这项研究探讨了 TKD 在结直肠癌(CRC)免疫检查点抑制(ICB)治疗中的作用。WB 显示,TKD 处理的癌细胞中 KRAS 的降解导致 HCT116 细胞中 IRF2 增加和 PD-L1 减少。流式细胞术分析也显示,TKD处 理的细胞表面 PD-L1 的表达显著降低。这些结果表明,TKD可以用于逆转突变 KRAS 引起的免疫抑制。
随后,在 C57BL/6 小鼠中使用 MC38K-luc 细胞构建盲肠移植 CRC 小鼠模型,单独或联合用 TKD 或 PD-1 抗体治疗小鼠。结果显示在 KRAS G12D 小鼠 CRC 细胞系 MC38K 中,TKD 同样导致 KRAS 降解并抑制细胞生长。TKD 显著增加了细胞毒性T细胞的数量,同时减少了 MDSCs,逆转了免疫抑制。联合使用 TKD 和 PD-1 抗体的治疗组肿瘤生长被显著抑制,且在盲肠组织中观察到协同抑制效果。重要的是,TKD 处理组和联合治疗组未出现肝转移,表明其对 CRC 进展的显著抑制。

▲TKD特异性靶向癌细胞并诱导溶酶体依赖性KRAS降解
总的来说,在这项研究中,该团队开发了一种肿瘤靶向 KRAS 降解剂的新型分子工具——TKD。TKD在 癌细胞中选择性结合 KRAS,并通过依赖于溶酶体的过程有效诱导 KRAS 降解,从而抑制肿瘤生长,且没有明显副作用。当与 PD-1 抗体联合使用时,可增强抗肿瘤效果。
除了以上两种 KRAS 降解剂外,目前还有30多种靶向 KRAS 的疗法正在临床评估中,并且未来会有更多方案出现,让我们一起期待后续的进展吧~
往期推荐
• Cell重磅!发现新型GSDMD激动剂,可利用细胞焦亡治疗癌症
• Nat. Cancer:发现EGFR/PI3K双重靶向抑制剂——MTX531
• Breaking News!TargetMol官网全面升级,全方位提升您的使用体验!
参考资料:
[1] Popow J, Farnaby W, Gollner A, et al. Targeting cancer with small-molecule pan-KRAS degraders. Science. 2024;385(6715):1338-1347. doi:10.1126/science.adm8684
[2] Cox AD, Der CJ. KRAS takes the road to destruction. Science. 2024;385(6715):1274-1275. doi:10.1126/science.ads2150
[3] Yang J, Wang QL, Wang GN, et al. A pan-KRAS degrader for the treatment of KRAS-mutant cancers. Cell Discov. 2024;10(1):70. Published 2024 Jun 28. doi:10.1038/s41421-024-00699-4
[4]Dharmaiah, S., Tran, T.H., Messing, S. et al. Structures of N-terminally processed KRAS provide insight into the role of N-acetylation. Sci Rep 9, 10512 (2019).
其他文章



订阅TargetMol新闻
科学新闻、观点和分析的重要汇总,每个工作日都会发送到您的收件箱.