- 全部删除
 您的购物车当前为空
您的购物车当前为空

ML385 是一种新颖性和特异性的NRF2 抑制剂,通过抑制 NRF2 来调控抗氧化应激等生物学过程,具有抗炎和抗肿瘤活性。
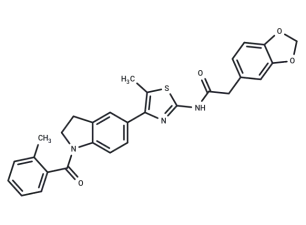
▲ML385的化学结构式
作用机制
ML385主要通过与NRF2的DNA结合域直接结合,抑制其与抗氧化反应元件(ARE)的结合,从而 下调 Nrf2 靶基因的表达。这些靶基因通常包括NQO1、HO-1等,它们参与细胞的氧化还原平衡和解毒代谢(如图1)。
NRF2 是一个转录因子,主要负责调节细胞的抗氧化防御和药物代谢相关基因的表达,当NRF2的活性被抑制后,肿瘤细胞失去了对氧化应激的耐受性,因此更容易受到化疗药物和放疗的作用。这使得ML385在肿瘤研究中尤为重要。
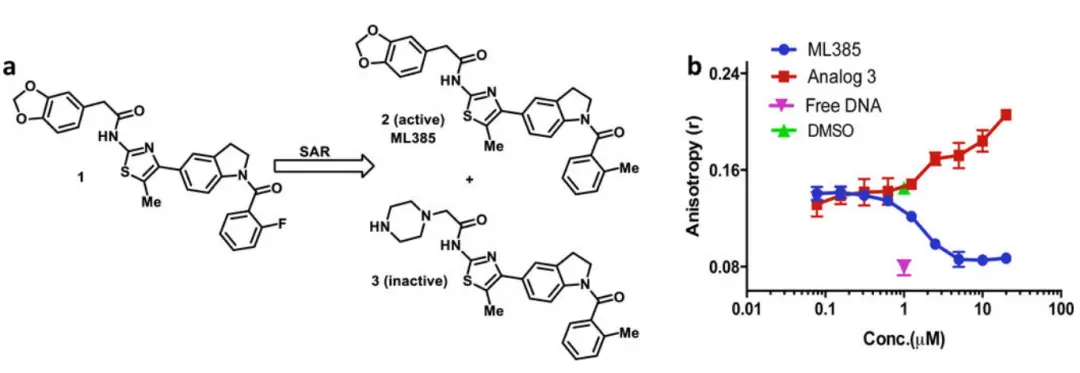
图1:ML385 抑制 NRF2-MAFG 复合物的 DNA 结合活性[1]
TargetMol明星分子限时半价

▲点击前往官网下单
更多规格,欢迎来询~
适用研究方向
抗肿瘤相关研究
ML385 的应用不仅限于白血病,还被研究用于其他癌症模型中以探讨其抑制肿瘤生长的潜力。
研究表明:当与铂类药物(如阿霉素或紫杉醇)联合使用时,与单独使用单一药物相比,ML385 显著增强了 NSCLC(非小细胞肺癌)细胞的细胞毒性。ML385 对 KEAP1 突变导致 NRF2 功能增强的 NSCLC 细胞具有特异性和选择性,因此靶向 NRF2 可能代表治疗晚期 NSCLC 的一种有前途的策略(如图2)。

图2:ML385 单独使用和与卡铂联合治疗皮下肺肿瘤异种移植物的治疗效果[1]
耐药机制相关研究
在抗癌治疗中,NRF2 被认为是某些肿瘤耐药性的关键因素,其活性可显著提高癌细胞对化疗药物的耐受性。研究显示,抑制 NRF2 可增强 Venetoclax(维奈妥拉)通过铁死亡途径诱导的急性髓性白血病(AML)细胞死亡,因此,ML385 与 Venetoclax 联合应用 可能为 AML 治疗提供一种有效策略[2]。
此外,耐药性是限制阿霉素(Doxorubicin)临床使用的主要障碍之一。作为一种广泛用于包括白血病在内多种癌症治疗的化疗药物,阿霉素的疗效在耐药性细胞中显著降低。研究表明,K67、视黄酸和 ML385 均能提高阿霉素在阿霉素耐药 HL-60/DR 细胞中的治疗效果,这为利用 NRF2 抑制剂联合阿霉素的治疗策略克服白血病耐药提供了潜在方向(如图 3)。
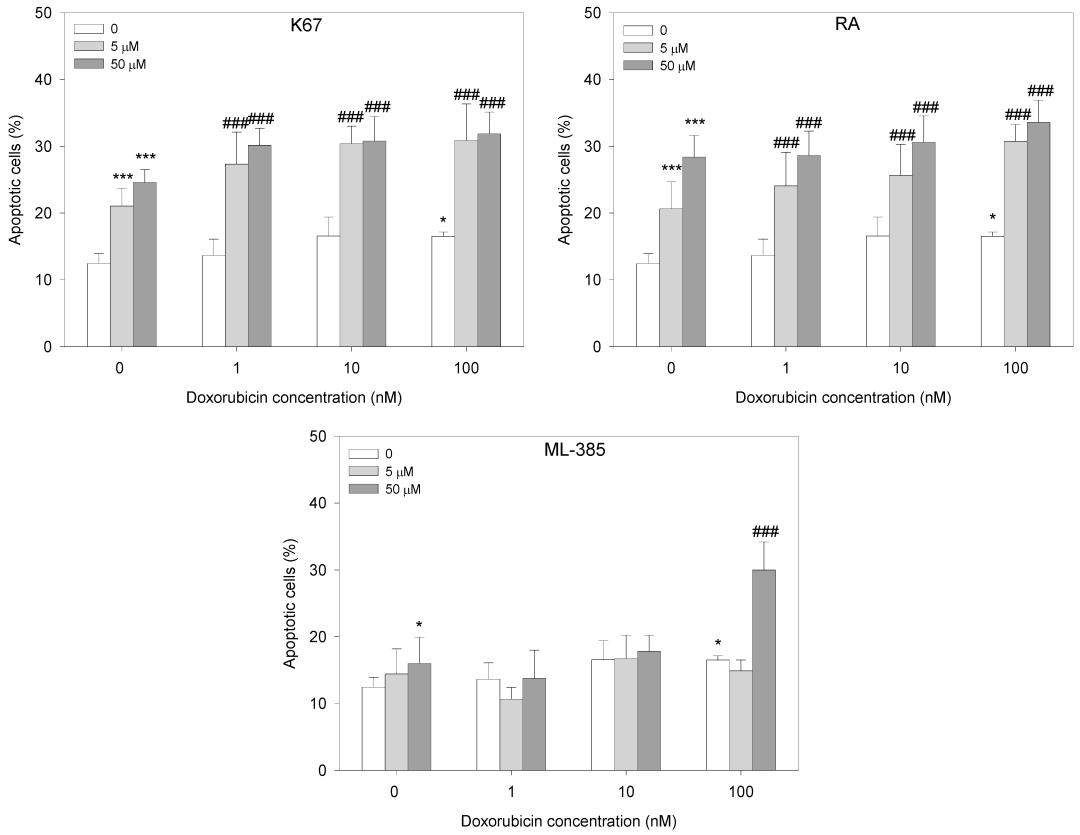
图3:NRF2 抑制剂-K67、视黄酸 (RA) 和 ML-385 预孵育 24 小时并用Doxorubicin处理24 小时HL-60/DR 的细胞凋亡情况[3]
氧化应激与抗炎机制研究
体内外研究表明,ML385 与 GPX4 抑制剂联合使用 能够显著增强氧化应激和铁死亡效应,在卵巢癌药物筛选和治疗中展现出强大的协同作用[4]。
此外,伤口愈合受损是糖尿病的主要并发症之一,其特点是长期炎症、延迟再上皮化及持续的氧化应激。其背后的机制尚未完全阐明,目前仍缺乏有效的治疗方法。研究发现,Nrf2 敲低或 使用 Nrf2 抑制剂 ML385 能够模拟糖尿病的作用,而激活 Nrf2 则能通过改善糖尿病相关的氧化应激和炎症,加速受损伤口的愈合。这一发现为利用 Nrf2 激活剂(如二甲基富马酸,DMF)促进糖尿病伤口愈合提供了新的临床治疗策略(如图 4)。
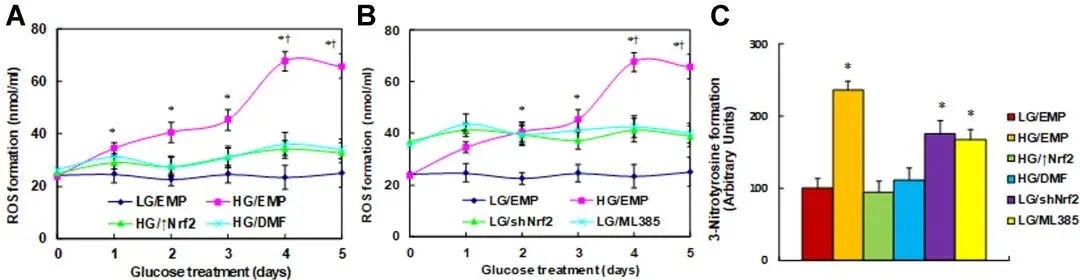
图4:NRF2 激活可恢复NRF2 抑制模拟高血糖诱导的 ROS 生成[5]
药物开发研究
垂体神经内分泌瘤 (PitNETs) 是人类第二常见的颅内肿瘤,药物治疗在 PitNETs 的管理中发挥着越来越大的作用,但是对于多巴胺受体 (DR) 和生长抑素受体 (SSTR) 这些靶点药物产生的耐药和其他 PitNET 亚型,仍然没有有效的治疗靶点和相应的药物。
研究发现,靶向组蛋白脱乙酰酶 (HDAC)的抑制剂 Panobinostat 可通过 NRF2 介导的氧化还原调节进行 PitNET 治疗的潜在药物,并且 Panobinostat 和 ML385 的组合 进一步增强了 PitNET 治疗的有效性(如图5所示)。
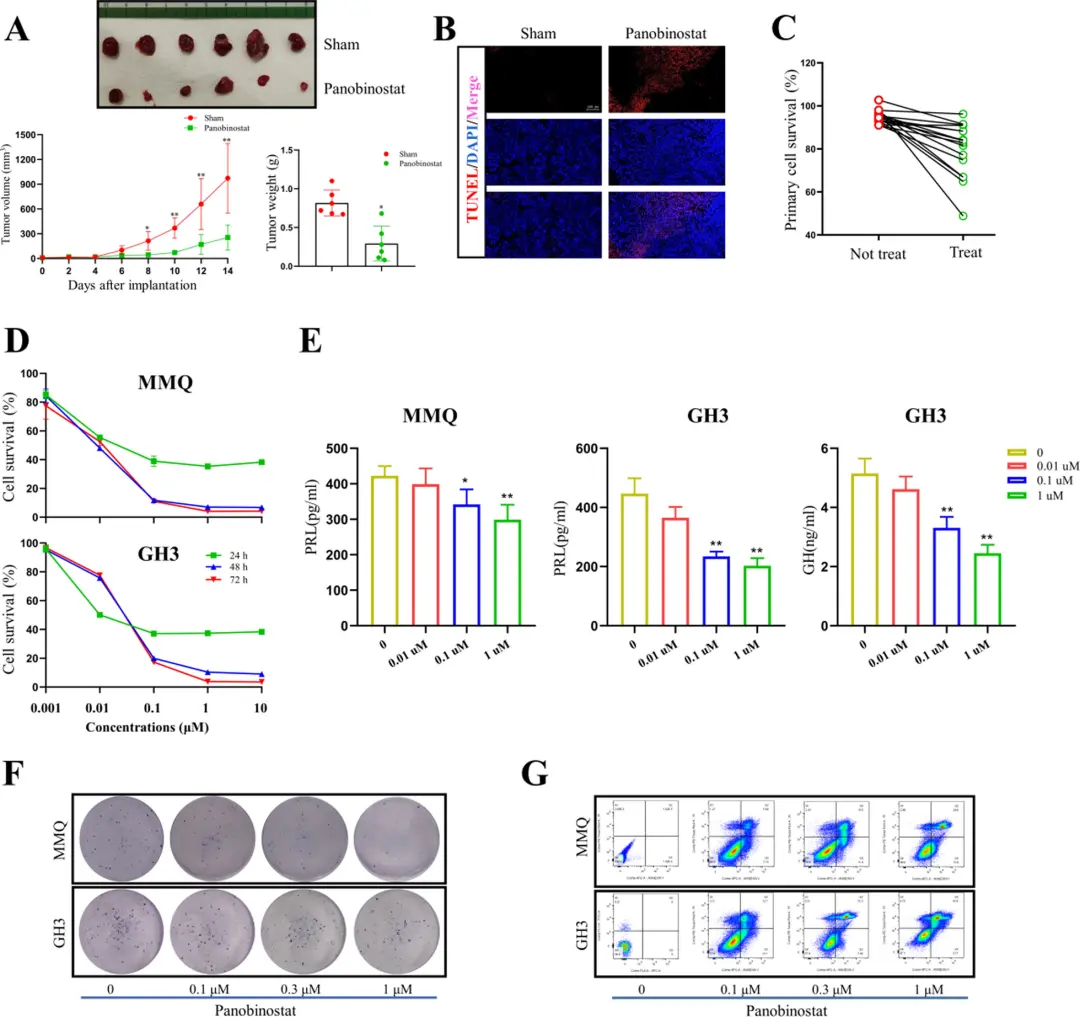
图5:高通量筛选得到的Panobinostat 在体内和体外均具有抗 PitNET 作用[6]
小结
总之,作为NRF2抑制剂,ML385在多个关键研究领域具有巨大潜力,包括癌症治疗、药物耐药性、神经退行性疾病和炎症性疾病。通过调节氧化应激和炎症反应,ML385有望成为克服化疗耐药性和减少慢性炎症的潜在治疗药物,特别是在类风湿关节炎和炎症性肠病等疾病中。
此外,ML385对神经退行性疾病和衰老过程的影响为老年疾病和细胞衰老研究开辟了新的方向。随着研究的深入,探索其治疗效果与安全性之间的平衡至关重要,尤其是在长期治疗或联合疗法中的应用。因此,ML385有望成为推动疾病机制理解和提升多种疾病治疗策略的重要工具。
参考资料:
[1]Singh A, et,al. Small Molecule Inhibitor of NRF2 Selectively Intervenes Therapeutic Resistance in KEAP1-Deficient NSCLC Tumors. ACS Chem Biol. 2016 Nov 18;11(11):3214-3225.
[2]Yu, X., J. et al. Inhibition of NRF2 enhances the acute myeloid leukemia cell death induced by venetoclax via the ferroptosis pathway. Cell Death Discov. 10, 35 (2024).
[3]Juszczak M,et,al. Potential of NRF2 Inhibitors-Retinoic Acid, K67, and ML-385-In Overcoming Doxorubicin Resistance in Promyelocytic Leukemia Cells. Int J Mol Sci. 2024 Sep 24;25(19):10257.
[4]Li, N., et al. Synergistic suppression of ovarian cancer by combining NRF2 and GPX4 inhibitors: in vitro and in vivo evidence. J Ovarian Res 17, 49 (2024).
[5]Li M, et,al. Nrf2 Suppression Delays Diabetic Wound Healing Through Sustained Oxidative Stress and Inflammation. Front Pharmacol. 2019 Sep 20;10:1099.
[6]Cheng Y, et,al. Therapeutic potential of targeting Nrf2 by panobinostat in pituitary neuroendocrine tumors. Acta Neuropathol Commun. 2024 Apr 18;12(1):61.
其他文章



订阅TargetMol新闻
科学新闻、观点和分析的重要汇总,每个工作日都会发送到您的收件箱.












