- 全部删除
 您的购物车当前为空
您的购物车当前为空

- 具有直观的搜索结果
- 更便捷高效地比较产品细节
- 快速、简洁的提交订单
- 成为我们TargetMol的一员,阅读和提交您的产品建议和意见
我们很想知道您的意见反馈,所以我们在每个页面上都梳理出一个反馈按钮。
细胞凋亡是维持机体组织稳态的重要机制之一,由内源性和外源性两种途径调控。在内源性途径中,B细胞淋巴瘤2(BCL-2)家族通过控制促凋亡和抗凋亡的细胞内信号在凋亡过程中发挥核心作用。今天T仔就带大家了解一下BCL-2相关的抑制剂有哪些~
BCL-2家族
BCL-2最初是在t(14;18)染色体易位中发现的,这种易位发生在滤泡性淋巴瘤和弥漫性大B细胞淋巴瘤(DLBCL)的患者中,并导致BCL-2转录水平升高。
BCL-2基因家族编码了20多种调控着内源性凋亡途径的蛋白。根据其功能可分为三种:
- 抗凋亡蛋白(如BCL-2、BCL-XL、BCL-W、MCL-1、BFL-1/A1);
- 促凋亡孔形成蛋白(如BAX、BAK、BOK);
- 促凋亡BH3-only蛋白(如BAD、BID、BIK、BIM、BMF、HRK、NOXA、PUMA等)
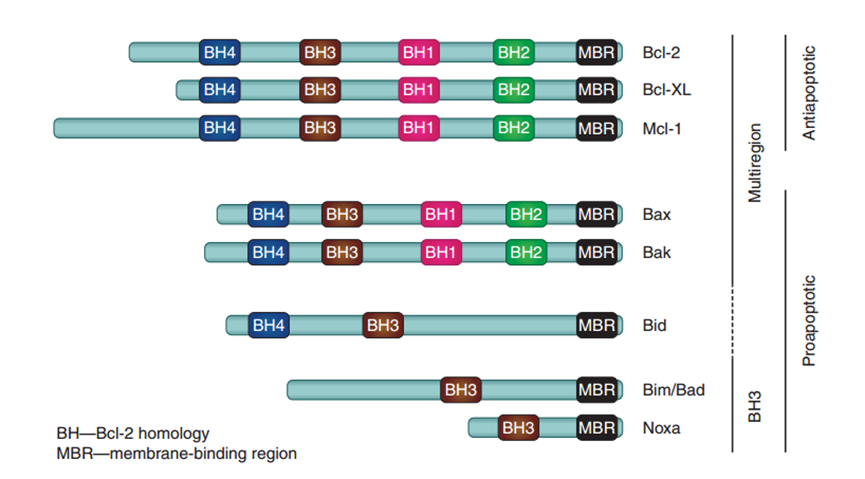
BCL-2蛋白家族
BCL-2调控凋亡的机制
在细胞应激信号激活内源性途径后,促凋亡的BCL-2同源3(BH3)蛋白抑制抗凋亡蛋白B细胞淋巴瘤2(BCL-2)、BCL-XL、BCL-W和骨髓细胞白血病1(MCL1)。随后,促凋亡蛋白BCL-2拮抗剂杀手1(BAK)和BCL-2相关X蛋白(BAX)的激活和聚合导致线粒体外膜通透化(MOMP)。这使得细胞色素c和第二种线粒体来源的半胱天冬酶激活因子(SMAC,也称为DIABLO)从线粒体释放出来。细胞色素c与procaspase 9和凋亡蛋白酶激活因子1(APAF1)形成复合物,从而激活caspase9。caspase9进一步激活procaspase3和procaspase7,最终导致细胞死亡。抗凋亡BCL-2蛋白通过结合其BH3基序来隔离促凋亡蛋白,可抑制这一过程。
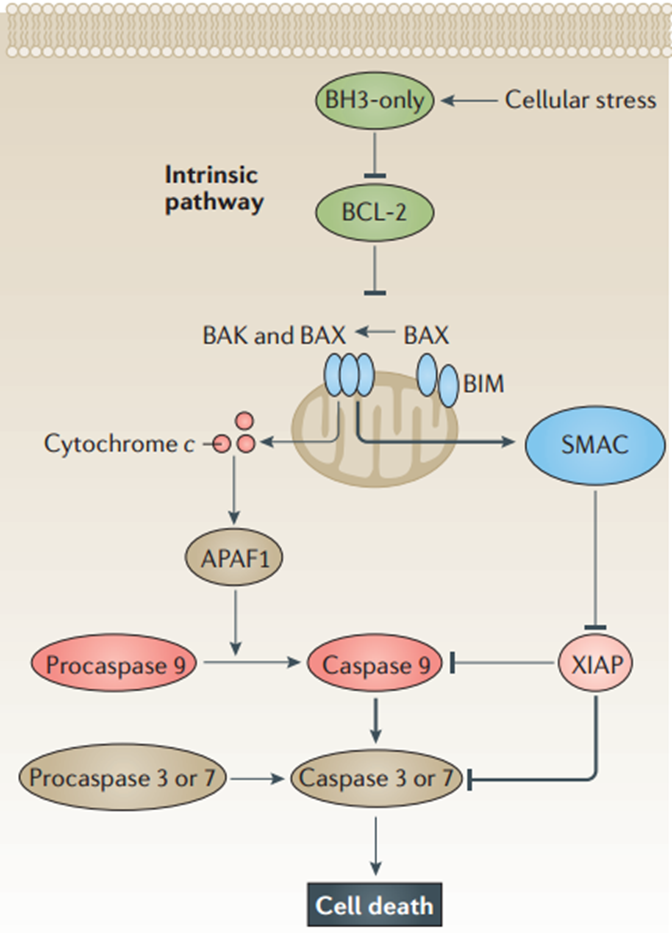
内源性凋亡途径
由于BCL-2介导的对内源性凋亡的抵抗是恶性肿瘤的标志,靶向抗凋亡BCL-2蛋白也是癌症治疗的一个热门研究策略。
早期研究主要通过筛选天然产物库以获得针对BCL-2的的化合物。虽然有多种化合物都进入了临床阶段,但没有一个达到了足够的疗效以获得批准。不过,随着技术的进步,针对BCL-2家族的小分子靶向药物取得了巨大的进步。下面介绍一下部分靶向BCL-2开发的药物。
BCL-2抑制剂
ABT-737是一种 BH3 模拟物,通过模仿BH3域的结构,结合到Bcl-2、Bcl-XL和Bcl-W的BH3结合口袋,从而阻断这些抗凋亡蛋白与促凋亡蛋白(如Bax和Bak)的相互作用。通过抑制这些抗凋亡蛋白,ABT-737可以促进细胞凋亡,特别是在那些依赖Bcl-2家族蛋白生存的肿瘤细胞中。
但ABT-737的口服吸收差,因此促使了二代模拟物navitoclax(ABT-263)的开发。Navitoclax对Bcl-2和Bcl-XL的亲和力较高,并且在临床研究中显示出更好的抗肿瘤效果。不过navitoclax会引起严重的副作用,导致血小板计数严重下降。
此外,还有结构类似于navitoclax的BM-1197。它以亚纳摩尔浓度的亲和力结合BCL-2和BCL-XL,并破坏促凋亡和抗凋亡BCL-2家族蛋白之间的相互作用,诱导SCLC细胞系中的BAX-BAK依赖性凋亡。以及双重BCL-2–BCL-XL抑制剂AZD4320等。
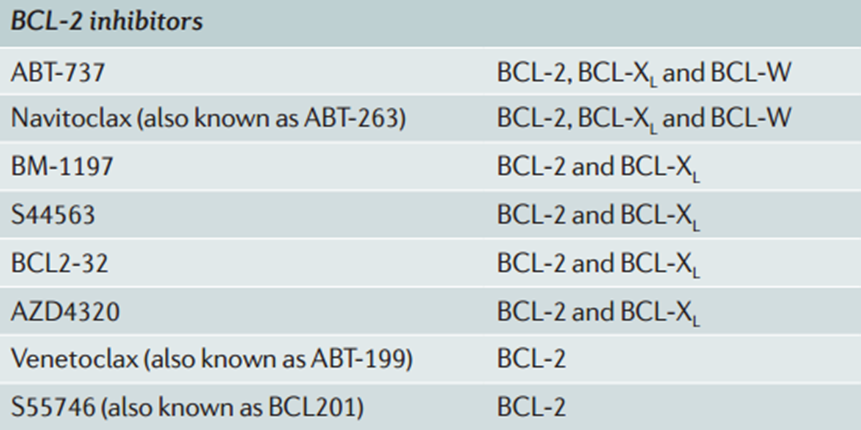
基于Navitoclax使用,科学家们想开发一种可选择性靶向BCL-2的抑制剂,在减少双重BCL-2-BCL-XL抑制所导致的血小板减少的同时,仍可以保持对肿瘤的疗效。随后发现了首个高选择性BCL-2抑制剂venetoclax。
Venetoclax对BCL-2的选择性抑制,避免了对BCL-xL的抑制,从而实现了诱导凋亡的治疗效果,且不会产生血小板减少的负面影响。Venetoclax通过直接结合BCL-2蛋白,排斥促凋亡蛋白,从而恢复凋亡过程,导致线粒体外膜通透化和半胱氨酸蛋白酶的激活。
S55746是第二种进入临床阶段的bcl - 2选择性抑制剂,对MCL-1、BFL-1(BCL2A1/A1)的结合不显著,对BCL-XL的亲和力较差。因此,S55746对BCL-XL依赖的细胞(如血小板)没有细胞毒性。在小鼠的CLL、MCL异种移植模型中表现出显著的抗肿瘤效果。
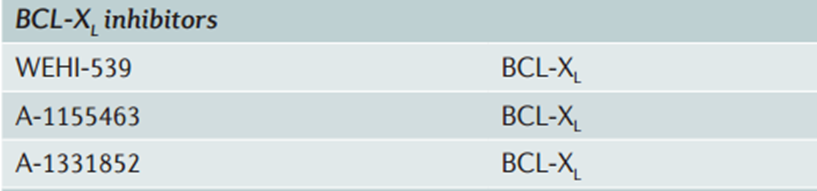
选择性BCL - XL抑制剂
针对BCL-XL的小分子抑制剂有WEHI-539,以及基于WEHI-539结构进一步优化开发的A-1155463和A-1331852等。其中A-1331852是较为有效的、高选择性的、口服生物可利用的BCL-XL抑制剂。BCL-XL选择性抑制剂能在固体肿瘤中增强多西他赛的疗效,同时限制navitoclax治疗中观察到的中性粒细胞减少症的发生。
选择性MCL1抑制剂
抗凋亡蛋白MCL1在多种原发肿瘤类型以及多发性骨髓瘤、急性髓系白血病、NSCLC和MYC驱动的淋巴瘤模型中,均有助于恶性细胞的生存。MCL-1不被ABT-737、Venetoclax或Navitoclax抑制,且是这些抑制剂潜在的耐药因素。
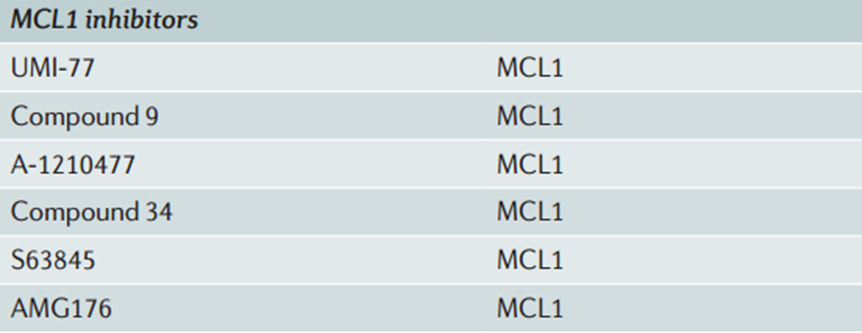
有药物学家通过高通量筛选(HTS)筛选了一系列对MCL1具有抑制作用的化合物,随后,通过CADD等技术开发了UMI-77。尽管UMI-77对MCL1的结合亲和力中等(半最大抑制浓度(Ki)= 500 nM),但其在微摩尔浓度下可抑制细胞生长并诱导BxPC-3胰腺癌细胞的凋亡。共同免疫沉淀实验表明,UMI-77可阻止MCL1与BAX和BAK的异二聚体形成。在BxPC-3异种移植模型中,UMI-77的静脉给药实现了显著的肿瘤生长抑制。
此外,还有A-1210477、S63845、AMG176等MCL1抑制剂陆续被开发。其中,AMG176是首个进入临床评估的MCL-1抑制剂。前正在针对复发性和难治性多发性骨髓瘤、淋巴瘤和急性髓细胞白血病的临床试验进行研究。
近年来,随着高通量筛选,CADD等技术的发展,BCL-2的研究和药物发现推动了选择性促凋亡药物的开发,这些药物有望改变特定恶性肿瘤的治疗方式。TargetMol 细胞凋亡化合物库精选 1760 种与凋亡相关的生物活性小分子化合物,适用于癌症和神经退行性疾病等相关研究。

参考文献:
[1] Kale J, Osterlund EJ, Andrews DW. BCL-2 family proteins: changing partners in the dance towards death. Cell Death Differ. 2018;25(1):65-80. doi:10.1038/cdd.2017.186
[2] Ashkenazi A, Fairbrother WJ, Leverson JD, Souers AJ. From basic apoptosis discoveries to advanced selective BCL-2 family inhibitors. Nat Rev Drug Discov. 2017;16(4):273-284. doi:10.1038/nrd.2016.253
[3] Shamas-Din A, Kale J, Leber B, Andrews DW. Mechanisms of action of Bcl-2 family proteins. Cold Spring Harb Perspect Biol. 2013;5(4):a008714. Published 2013 Apr 1. doi:10.1101/cshperspect.a008714
[4] Tait SW, Green DR. Mitochondria and cell death: outer membrane permeabilization and beyond. Nat Rev Mol Cell Biol 2010; 11: 621–632
其他文章





订阅TargetMol新闻
科学新闻、观点和分析的重要汇总,每个工作日都会发送到您的收件箱.

 嗨!很高兴为您提供帮助!
嗨!很高兴为您提供帮助!











